Реферат: Характеристика антитіл та імуноглобулінів
Вступ
1. Будова і властивості антитіл
2. Характеристика імуноглобулінів різних класів
2.1 Імуноглобулін А
2.2 Імуноглобулін Е
2.3 Імуноглобулін G
2.4 Імуноглобулін М
Висновок
Список використаних джерел
Вступ
Імуноглобуліни (антитіла) мають здатність специфічно з'єднуватись з антигеном і є найважливішими молекулами імунологічної системи. Тому докладне вивчення їх будови, властивостей і утворення є передумовою розуміння імунологічних механізмів.
Є чотири риси гуморальної імунної відповіді, що вражають і, на перший погляд, взаємно виключають одна одну:
1) універсальність: антитіла можуть бути виробленими проти будь-якого хімічного угрупування. Важко уявити, скільки повинно бути варіантів антитіл, якщо вважати, що кожний антиген потребує окремого антитіла;
2) специфічність: антитіла розрізняють о- чи р-положення функціональних груп, стереоізомери, білки, що відрізняються на один амінокислотний залишок;
3) гетерогенність: на один антиген виробляється багато типів (популяцій) антитіл, інколи більше 100 на одну антигенну детермінанту;
4) поліфункціональність: одне антитіло здатне зв'язувати більш, ніж один антиген.
1. Будова і властивості антитіл
Імуноглобуліни знаходяться в біологічних рідинах всіх хребетних. Молекула імуноглобуліну збудована з чотирьох поліпептидних ланцюгів (рис. 1): 2 легких L (light) і 2 важких Н (heavy), поєднаних між собою дисульфідними зв'язками. Залежно від відмінностей будови важких ланцюгів: а (альфа), 8 (дельта), є (епсілон), у (гамма), і \х (мю), імуноглобуліни можна розділити відповідно на 5 класів: IgA, IgD, IgE, IgG, IgM (табл. 1). Легкі ланцюги можуть існувати у двох варіантах: типу к (каппа) і типу λ (лямбда). Відповідно до незначної різниці у будові важких ланцюгів у межах одного класу виділяють підкласи, наприклад igGl , IgG2, IgG3, IgG4. Існують аналогічні різновиди легких ланцюгів λ. Такі варіанти будови ланцюгів важких (класи, підкласи) і легких (типи, підтипи) називаються ізотипічними варіантами антитіл. Імуноглобуліни можуть існувати як в мономерпій (чотири ланцюги), так і в полімерній формі. IgA у сироватці крові присутній в основному як мономер, а в виділеннях екзокринних залоз - як димер. Натомість IgM завжди є у формі пентамеру (рис. 2). Полімерні форми мають додатковий зв'язуючий поліпептидний ланцюг J (joining). Він є білком з масою 15 kDa, що містить 8 залишків цистеїну. В утворенні полімерних форм бере участь сульфгідрильна оксидаза, що окислює групу SH. Ланцюг J не є необхідним для виникнення полімерних форм імуноглобулінів, оскільки можна виявити полімери імуноглобулінів, позбавлені ланцюга J. Його відсутність не впливає на утворення гексамерів замість пентамерів IgM. Ланцюг J не має нічого спільного з геном (або ділянкою) j, що кодує відтинок змінної частини легкого або важкого ланцюга.
У легких і важких ланцюгах антитіл можна виділити змінні частини (V), що лежать у кінцевому N відрізку (вільні амінні групи поліпептидних ланцюгів), а також постійні частини (С), що займають С-кінці (вільні карбоксильні групи поліпептидних ланцюгів).
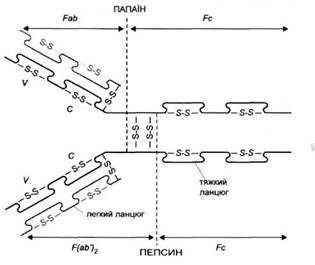
Рис. 1. Схема будови імуноглобуліму. Fab - фрагмент, що зв'язує антиген, Fc - кристалізуючий фрагмент, V- варіабельна частина, С-стабільна частина, S-S - дисульфідні містки. Пунктиром позначено місця гідролізу папаїном і пепсином
У результаті дії папаїну молекула IgG розпадається на два фрагменти Fab (який містить центри, що зв'язують антиген) і на фрагмент Fc (рис. 1). Частина важкого ланцюга, що міститься у фрагменті Fab, позначається символом Fd. Фрагмент антитіла, що зв'язує антиген, називається паратопом. Він просторово відповідає антигенній детермінанті - епітопу. Близько від місця розщеплення під дією папаїну знаходиться так звана рухлива ділянка, що робить можливим зміни кутів розташування Fab по відношенню до себе і до Fc. У цій ділянці знаходяться дисульфідні зв'язки, що з'єднують обидва важкі ланцюги між собою. їх може бути від 2 (IgGl) до 11 (IgG3). У фрагменті Fc антитіл знаходяться ділянки, відповідальні за активацію комплементу, а також за зв'язування з клітинними рецепторами для фрагмента Fc антитіл (FcR) .
Внаслідок гідролізу IgG, пепсином утворюється фрагмент F(ab')., і фрагмент Fc'. Руйнування дисульфідного звязку в фрагменті F(ab') призводить до утворення 2 фрагментів Fab'. До складу фрагментів Fab, Fab', F(ab')2 входять цілі легкі ланцюги і фрагменти важких ланцюгів зі змінною ділянкою і частиною незмінної ділянки. Так званий фрагмент Fv складається виключно із змінних частин важкого і легкого ланцюга.
Специфічність антитіла безпосередньо залежить від просторової конфігурації змінних ділянок важких і легких ланцюгів. Ця конфігурація залежить від порядкового розміщення амінокислот у цих частинах ланцюгів. Змінні ділянки, що входять до складу фрагмента Fab антитіл, різні в антитіл, що зв'язують різні епітопи, а незмінні ділянки однакові у всіх антитіл даного класу і підкласу.
Серед антитіл одної специфічності, що зв'язують той самий епітоп, можуть ще бути відмінності за рівнем відповідності, тобто спорідненості антитіла до антигену. Від рівня цієї відповідності залежить сила зв'язування антигену антитілом.
Антитіла, що реагують перехресно, - це такі антитіла, які зв'язують як антиген А, так і антиген В. Причиною цього може бути подібність епітопів антигенів або те, що антигени мають багато різних епітопів, а частина їх однакова для обох антигенів. Цьому сприяє факт певної еластичності ділянки, що зв'язує антиген, яка може пристосуватися до дещо просторово різних антигенів.
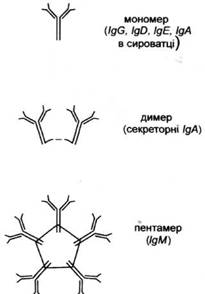
Рис. 2. Мономерна форма і полімерні форми імуноглобулінів
Змінна частина кожного з ланцюгів складається з трьох ділянок дуже змінних і з чотирьох різних ділянок, які прилягають до них (frame region - FR). Антитіла різної специфічності в основному відрізняються послідовністю амінокислот у дуже змінних ділянках. Ці ділянки визначають специфічність антитіл, бо вони власне утворюють місце зв'язування антигену. З цього приводу ці ділянки деколи називають регіонами, що визначають відповідність (complementarity determining regions - CDR). Ці ділянки є ніби "гарячими" місцями імуноглобулінів (рис. 3, 4).
Таблиця 1
Основні властивості імуноглобулінів різних класів у людини
| Властивості | IgG | IgА | IgM | IgD | IgE |
| Форма | мономер | мономер димер | пентамер | мономер | мономер |
| Підкласи | IgGl-IgG4 | IgA1, IgA2 | - | - | - |
| Інші ланцюги | - | J, секре-торний фрагмент | J | - | |
| Період півіснування (дні) | 23 | 5,8 | 5,1 | 2,8 | 2,5 |
| Синтез (мг/кг маси/день) | 33 | 65 | 6,7 | 0,4 | 0,016 |
| Середня концентрація в сироватці | 8-16 | 1,4-4 | 0,5-2 | 0,04 | 1,7 х10-5 -4,5 х 10-4 |
| Активація комплементу (класичний шлях) | + а) | - | + | - | - |
| Проходження крізь плаценту | + | - | - | - | - |
| Зв'язування з людськими мастоцитами | -а) | - | - | - | + |
| Молекулярна маса (х 103 ) | 150 | 160 і димер | 970 | 185 | 190 |
| Число основних 4-ланцюгових одиниць | 1 | 1 або 2 | 5 | 1 | 1 |
| Відсоток серед імуноглобулінів сироватки | 80 | 13 | 6 | 0-1 | 0,002 |
| Відсоток вуглеводів | 2-3 | 7-11 | 12 | 9-14 | 12 |
--> ЧИТАТЬ ПОЛНОСТЬЮ <--