Реферат: Характеристика антитіл та імуноглобулінів
Детальні дослідження зв'язування мишачим антитілом великого білкового антигену (лізоцим курячого яйця) показали, що антитіло контактує з антигеном через 17 амінокислот. З них 10 належало важкому ланцюгу, а 6 - легкому. Вони належали до всіх дуже змінних ділянок антитіла, а особливо до ділянки CDR3 важкого ланцюга. Дві амінокислоти належали також до ділянок "зрізу". Площа контакту близько 7,5 нм2 , що становило 11 % доступної поверхні антигену.
Тепер вважають, що лише зв'язування антигену певного імуноглобуліну може в деяких випадках зв'язувати два цілком різні епітопи у двох різних "закутках" цього місця. Це відкриття похитнуло один з дотеперішніх канонів імунології, який вважав, що один імуноглобулін може зв'язувати тільки один специфічний епітоп.
Завдяки повторенню лінійної послідовності амінокислот як легкі, так і важкі ланцюги містять так звані гомологічні зони або домени, які охоплюють близько 110 амінокислот і петлі, закриті дисульфідними зв'язками (близько 60 амінокислот). Змінні ділянки легких і важких ланцюгів і стабільні ділянки легких ланцюгів містять тільки по одному домену. Постійні ділянки важких ланцюгів IgA, IgG, IgD містять по 3 домени, a IgE, IgM no чотири домени, оскільки замість рухливої ділянки останні імуноглобулі-ни мають додатковий домен.
Домени незмінних ділянок мають характерну конфігурацію, яку називають складкою Ig. Вона складається з розташованих паралельно двох "гофре" β, з'єднаних дисульфідним зв'язком, одне з яких містить 3, а друге - 4 пасма β. Домени змінних ділянок мають 8 пасм β замість 7.
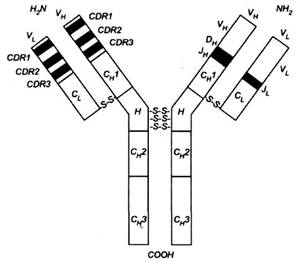
Рис. 3. Імуноглобулін. З лівого боку схеми у варіабельних частинах тяжких і легких ланцюгів позначено гіперваріабельні регіони (CDR) - темні поля і регіони зрізу -світлі поля, які прилягають до ділянок CDR. З правого боку схеми позначено відрізки, які відповідають генам У, D і J, котрі кодують варіабельні частини. У стабільних частинах позначено гомологічні зони, тобто домени, один для легкого ланцюга (С; ) і три для тяжкого ланцюга (СН 1, СІ{ 2 і СІП ). Н - регіон завіс.
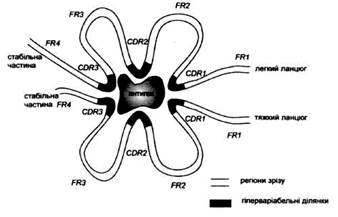
Рис. 4. Спрощена схема просторової будови місця зв'язування антигену. CDR - гіперваріабельні ділянки, FR -регіони зрізу
У IgA, IgD, IgM ще додатково є хвостові ділянки (tailpieces). У IgA та IgM вони беруть участь в утворенні полімерних форм.
За перші дослідження структури антитіл Едельман і Портер в 1972 р. отримали Нобелівську премію.
Крім вільних (циркулюючих) імуноілобулінів В -лімфоцити виробляють також імуноглобуліни, які вбудовані в їхню клітинну оболонку С-кінцем і є рецепторами, що зв'язують антиген.
Всі імуноглобуліни містять приєднані полісахаридні ланцюги. Наприклад, людські IgG мають два або три N-зв'язані олігополісахариди. Два з них зв'язані з аспарагінами в позиції 294 фрагмента Fc. Відсутність цих олігосахаридів порушує з'єднання IgG з рецепторами для ділянки Fc-фрагмента антитіл на макрофагах і моноцитах.
Імуноглобуліни мають три різних види антигенних маркерів, що дозволяє їх класифікувати. Цими маркерами є:
• ізотипні (обумовлені певними суттєвими відмінностями в будові легких і важких ланцюгів - поділ на класи і типи). Здорові особи мають, як правило, всі ізотипні різновиди.
• алотипні - залежать від наявності в важких і легких ланцюгах (в основному в стабільних ділянках) різних амінокислот у певній позиції поліпептидного ланцюга. У різних представників одного виду можна знайти різні алотипні варіанти. Гени, що кодують незмінні ділянки імуноглобулінів, є поліалельними генами. Алотипні варіанти, тобто алотипи, є у важких ланцюгів γ (усіх підкласів), μ і α, а також легких ланцюгів к іλ . Найліпше вивчено алотипи ланцюга у, яких є кільканадцять і позначаються вони символом Gm та черговою цифрою. Імунізація проти алотипних детермінант відбувається при переливанні крові, вагітності, алогенній трансплантації;
• ідіотипні - пов'язані з відмінностями будови змінних ділянок поліпептидних ланцюгів. Антитіла одної специфічності мають однакові ідіотипні маркери.
2. Характеристика імуноглобулінів різних класів
2.1 Імуноглобулін А
Наш організм виробляє більше IgA порівняно з іншими імуноглобулінами, разом взятими. Організм дорослої людини з масою тіла 70 кг виробляє за добу 3 г IgG і 3,6-9,2 г IgA. Хоча в сироватці IgA менше, ніж IgG, слід пам'ятати, що більшість IgA виробляється місцево на слизових оболонках і виділяється з організму слизово-серозними виділеннями. Секреторний IgA є головним елементом захисту слизових оболонок від нападу мікроорганізмів, а слизові потенційно є найбільшими воротами захисту від інфекцій.
Крім виконання своїх захисних функцій у слизово-серозних виділеннях IgA може також брати участь у протиінфекційному імунітеті вже всередині епітеліальних клітин слизових, через які він транспортується (трансцитоз) до просвіту органа (наприклад кишківника). У випадку зараження епітеліальних клітин вірусами IgA, що транспортується крізь ентероцити, може нейтралізувати віруси вже всередині ентероцитів.
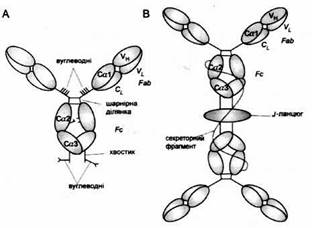
Рис. 5. Схема будови IgA.
A. Мономер IgA 1 із сироватки. Він нагадує будовою IgG, але містить хвостові відрізки і видовжений регіон завіс з приєднанами вуглеводневими групами і дисульфідними містками, який охоплює відрізки доменів Сα2.
B. Секреторний димер IgA. J-ланцюг, що нагадує домен Ig, зв'язує хвостові відрізки двох мономерів IgA через дисульфідні містки. Секреторний фрагмент, який нагадує п'ять доменів Ig, нековалентно з'єднується з Fс-фрагментом та J-ланцюгом і утворює поодинокий дисульфідний місток з одним із мономерів IgA
У плазмі людини IgA на 80-95 % знаходиться у мономерній формі, а решту складають полімерні форми, що містять з'єднуючий ланцюг J : димери, меншою мірою тримери і тетрамери. Ланцюг J з'єднується дисульфідними зв'язками з хвостовою частиною IgA.
У слизових і слизово-серозних виділеннях, таких як сльози, піт, виділення залоз шлунково-кишкового тракту, дихальних, сечовивідних, статевих шляхів, IgA присутній у формі димерів, зв'язаних додатково з так званим секреторним фрагментом (рис. 5). Це секреторні IgA або S-IgA (secretory IgA). S-IgA становить також 5-10 % від загальної кількості полімерного IgA в сироватці крові. Існує два його підкласи: IgA1 і lgA2.
Антитіла підкласу IgAl мають видовжену, збудовану з 20 амінокислот рухливу ділянку, а в підкласу IgA2 ця ділянка значно коротша, бо містить лише 7 амінокислот. IgAl в сироватці становить 80-90 % від загальної кількості IgA, а в слизово-серозних виділеннях два підкласи присутні в більш-менш рівних кількостях. Скорочена рухлива ділянка IgA1 робить його невразливим до дії бактерійних протеаз, які можуть перетяти і пошкодити IgA1. Слід пам'ятати, що IgA2 присутній саме у просвіті шлунково-кишкового тракту, де власне і є різні протеази. Хоча в людини є два гени а, у більшості тварин є лише один ген (відсутні підкласи), а у кроля їх аж 13.
У більшості антитіл IgA легкі ланцюги зв'язані дисульфідним зв'язком між собою, а не з важкими ланцюгами. Тому Fab фрагмента дуже зближені між собою і рухливість одного стосовно другого є обмежена.
2.2 Імуноглобулін Е
IgE, так само як і IgM, містить аж 4 домени у незмінній ділянці важкого ланцюга, але не має рухливої ділянки. На відміну від IgM, IgE не містить хвостової ділянки. Імуноглобуліни цього класу зв'язуються з відповідними рецепторами FcR на мастоци-тах, викликаючи після приєднання антигену дегрануляцію (вивільнення вмісту гранул) цих клітин, що лежить в основі анафілаксії.
Міститься у сироватці крові, концентрація невелика. Основна функція - індукція гострої реакції запалення шляхом звільнення медіаторів запалення: вазоактивних амінів - гістаміну та серотоніну - із тучних клітин. Цей процес запускається після взаємодії IgE з антигеном. В нормі медіатори запалення викликають приток у місце інфекції IgG антитіл, комплементу, нейтрофілів, еозинофілів, що сприяє подоланню інфекції. Однак у цьому цілком нормальному механізмі часто трапляється збій, і тоді організм починає раптово відповідати надто сильно, неадекватно, на якийсь незначний і не небезпечний антиген типу пилку рослин чи бджолиної отрути. Тоді виникає алергічна реакція: анафілактичний шок, сінна лихоманка, бронхіальна астма. IgE - головні медіатори алергії.
2.3 Імуноглобулін G
Всі підкласи IgG містять рухливу ділянку, а у IgG3 вона дуже видовжена (62 амінокислоти), що робить його подібним до IgD. У рухливій ділянці gG3 аж 11 дисульфідних зв'язків, які з'єднують важкі ланцюги. IgG1, IgG2, IgG4 з'єднуються Fc-фрагментом з А-білком золотистого стафілококу.