Реферат: Химические соединения на основе кремния и углерода
Аморфный кремний - порошок бурого цвета. Последний легко получить в кристаллическом состоянии в виде серых твердых, но довольно хрупких крис таллов. Кристаллический кремний - полупроводник. [4,453-454]
Таблица 1. Общие химические данные об углероде и кремнии.
| С | Sі | |
| Электронная конфигурация | 2s2 2p2 | 3s2 3р2 |
| Ковалентный радиус, нм | 0,077 | 0,118 |
| Ионный радиус, нм | 0,016 | 0,040 |
| (+4) | (+4) | |
| Энергия ионизации, эВ | 11,26 | 8,15 |
| Сродство к электрону, эВ | 1,27 | 1,36 |
| Тпл , К | 4023 | 1693 |
| Ткип, К | 4473 | 3573 |
|
Плотность, г/см3 | 2,26 | 2,33 |
| Твердость по шкале Мооса | 10 | 7 |
| Электроотрицательность | 2,50 | 1,74 |
| Степень окисления | - 2, 2, 4 | - 4, 2, 4 |
| Содержание в земной коре, масс % | 9.10-2 | 16,7 |
Устойчивая при обычной температуре модификация углерода - графит - представляет собой непрозрачную, серую жирную массу. Алмаз - самое твердое вещество на земле - бесцветен и прозрачен. Кристаллические структуры графита и алмаза приведены на рис.1.
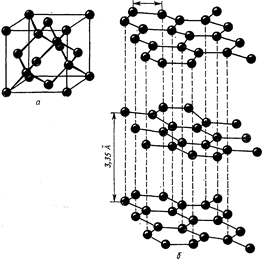
Рисунок 1. Структура алмаза (а); структура графита (б)
Углерод и кремний имеют свои определенные производные.
Таблица 2. Наиболее характерные производные углерода и кремния
| Гидриды | Оксиды | Сульфиды | Хлориды | Комплексные соединения |
| СН4 | СО, СО2 | cs, cs., | CCl4 | |
| SiH, | SiOa, (SiО | SiS, SiS2 | SiCl4 | H2 [SiF6 ], K2 [SiF6], |
| в парах) | MІ 4 Si (Мо3 О10 ),] |
1.2 Получение, химические свойства и применение простых веществ
Кремний получают восстановлением оксидов углеродом; для получения в особо чистом состояний после восстановления вещество переводят в тетрахлорид и снова восстанавливают (водородом). Затем сплавляют в слитки и подвергают очистке методом зонной плавки. Слиток металла нагревают с одного конца так, чтобы в нем образовалась зона расплавленного металла. При перемещении зоны к другому концу слитка примесь, растворяясь в расплавленном металле лучше, чем в твердом, выводится, и тем самым металл очищается.
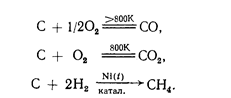
Углерод инертен, но при очень высокой, температуре (в аморфном состоянии) взаимодействует с большинством металлов с образованием твердых растворов или карбидов (СаС2 , Fе3 С и т.д.), а также со многими металлоидами, например:
2С+ Са = СaC2, С + 3Fe = Fe3 C,
Кремний более реакционно способен. С фтором он реагирует уже при обычной температуре: Si+2F2 =SiF4
У кремния очень большое сродство также и к кислороду:
![]()
Реакция с хлором и серой протекает около 500 К. При очень высокой температуре кремний взаимодействует с азотом и углеродом:
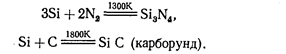
С водородом кремний непосредственно не взаимодействует. Кремний растворяется в щелочах:
Si+2NaOH+H2 0=Na2 Si03 +2H2 .
Кислоты, кроме плавиковой, на него не действуют. С HF идет реакция
Si+6HF=H2 [SiF6 ] +2H2 .
Углерод в составе различных углей, нефти, природных (в основном СН4), а также искусственно полученных газов - важнейшая топливная база нашей планеты [4,17]
Графит широко используется для изготовления тиглей. Стержни из графита применяются как электроды. Много графита идет на производство карандашей. Углерод и кремний применяются для производства различных сортов чугуна. В металлургии углерод используется как восстановитель, а кремний из-за большого сродства к кислороду-как раскислитель. Кристаллический кремний в особо чистом состоянии (не более 10-9 ат.% примеси) используется как полупроводник в различных устройствах и приборах, в том числе в качестве транзисторов и термисторов (приборов для очень тонких измерений температур), а также в фотоэлементах, работа которых основана на способности полупроводника при освещении проводить ток.
Глава 2. Химические соединения углерода
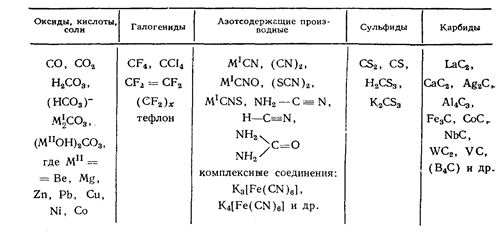
Для углерода характерны прочные ковалентные связи между собственными атомами (С-С) и с атомом водорода (С-Н), что нашло отражение в обилии органических соединений (несколько сот миллионов). Кроме прочных связей С-Н, С-С в различных классах органических и неорганических соединений, широко представлены связи углерода с азотом, серой, кислородом, галогенами, металлами (см. табл.5). Столь высокие возможности образования связей обусловлены малыми размерами атома углерода, позволяющими его валентным орбиталям 2s2 , 2p2 максимально перекрываться. Важнейшие неорганические соединения описаны в таблице 3.
Среди неорганических соединений углерода уникальными по составу и строению являются азотсодержащие производные.
В неорганической химии широко представлены производные уксусной СНзСООН и щавелевой H2 C2 О4 кислот - ацетаты (типа М'СНзСОО) и оксалаты (типа MI 2 C2 О4 ).
Таблица 3. Важнейшие неорганические соединения углерода.
2.1 Кислородные производные углерода
2.1.1 Степень окисления +2
Оксид углерода СО (угарный газ): по строению молекулярных орбиталей (табл.4).