Реферат: Химические соединения на основе кремния и углерода
СО+Сl2 =СОСl2 (фосген),
СО+Вг2 =СОВг2, Сг+6СО=Сг (СО) 6 -карбонил хрома,
Ni+4CO=Ni (CO) 4 - карбонил никеля
СО+Н2 0пар =НСООН (муравьиная кислота).
Вместе с тем молекула СО имеет большое сродство к кислороду:
СО +1/202 =С02 +282 кДж/моль.
Из-за большого сродства к кислороду оксид углерода (II) используется как восстановитель оксидов многих тяжелых металлов (Fe, Co, Pb и др.). В лаборатории оксид СО получают обезвоживанием муравьиной кислоты
![]()
В технике оксид углерода (II) получают восстановлением С02 углем (С+С02 =2СО) или окислением метана (2СН4 +ЗО2 = =4Н2 0+2СО).
Среди производных СО представляют большой теоретический и определенный практический интерес карбонилы металлов (для получения чистых металлов). [3,289]
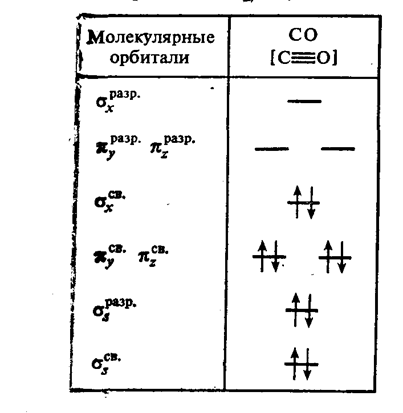
![]() Химические связи в карбонилах образуются в основном по донорно-акцепторному механизму за счет свободных орбиталей d- элемента и электронной пары молекулы СО, имеет место также л-перекрывание по дативному механизму (металл СО). Все карбонилы металлов - диамагнитные вещества, характеризующиеся невысокой прочностью. Как и оксид углерода (II), карбонилы металлов токсичны.
Химические связи в карбонилах образуются в основном по донорно-акцепторному механизму за счет свободных орбиталей d- элемента и электронной пары молекулы СО, имеет место также л-перекрывание по дативному механизму (металл СО). Все карбонилы металлов - диамагнитные вещества, характеризующиеся невысокой прочностью. Как и оксид углерода (II), карбонилы металлов токсичны.
Таблица 4. Распределение электронов по орбиталям молекулы СО
2.1.2 Степень окисления +4
Диоксид углерода С02 (углекислый газ). Молекула С02 линейна. Энергетическая схема образования орбиталей молекулы С02 приведена на рис.2. Оксид углерода (IV) может взаимодействовать с аммиаком по реакции.
![]()
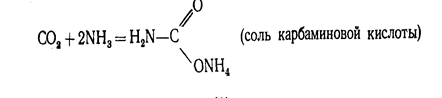
При нагревании этой соли получают ценное удобрение - карбамид СО (МН2 ) 2 :
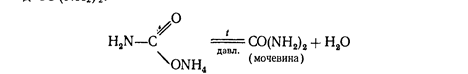
Мочевина разлагается водой
CO (NH2 ) 2 +2HaO= (МН4 ) 2СОз.

Рисунок 2. Энфгетическая диаграмма образования молекулярных орбиталей С02.
В технике оксид СО2 получают разложением карбоната кальция или гидрокарбоната натрия:

В лабораторных условиях его обычно получают по реакции (в аппарате Киппа)
СаСОз+2НС1=СаС12+С02+Н20.
Важнейшими производными С02 являются слабая угольная кислота Н2 СОз и ее соли: MI 2 СОз и MI НСОз (карбонаты и гидрокарбонаты соответственно).
Большинство карбонатов нерастворимо в воде. Растворимые в воде карбонаты подвергаются значительному гидролизу:
![]()
![]() COз2- +H2 0 COз-+OH - (I ступень).
COз2- +H2 0 COз-+OH - (I ступень).
Из-за полного гидролиза из водных растворов нельзя выделить карбонаты Cr3+ , ai3 +, Ti4+ , Zr4+ и др.