Реферат: Химия белка
Первичная структура белка - последовательность аминокислотных фрагментов, прочно (и в течение всего периода существования белка) соединенных пептидными связями. Существует период полужизни белковых молекул - для большинства белков около 2-х недель. Если произошел разрыв хотя бы одной пептидной связи, то образуется уже другой белок.
ВТОРИЧНАЯ СТРУКТУРА
Вторичная структура - это пространственная организация стержня полипептидной цепи. Существуют 3 главнейших типа вторичной структуры:
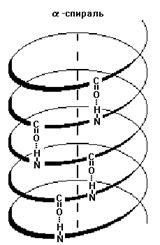
1) Альфа-спираль - имеет определенные характеристики: ширину, расстояние между двумя витками спирали. Для белков характерна правозакрученная спираль. В этой спирали на 10 витков приходится 36 аминокислотных остатков. У всех пептидов, уложенных в такую спираль, эта спираль абсолютно одинакова. Фиксируется альфа-спираль с помощью водородных связей между NH-группами одного витка спирали и С=О группами соседнего витка. Эти водородные связи расположены параллельно оси спирали и многократно повторяются, поэтому прочно удерживают спиралеобразную структуру. Более того, удерживают в несколько напряженном состоянии (как сжатую пружину).
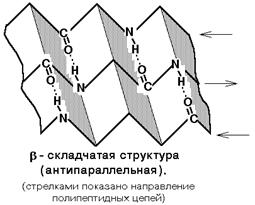
Бета-складчатая структура - или структура складчатого листа. Фиксируется также водородными связями между С=О и NH-группами. Фиксирует два участка полипептидной цепи. Эти цепи могут быть параллельны или антипараллельны. Если такие связи образуются в пределах одного пептида, то они всегда антипараллельны, а если между разными полипептидами, то параллельны.
3) Нерегулярная структура - тип вторичной структуры, в котором расположение различных участков полипептидной цепи относительно друг друга не имеет регулярного (постоянного) характера, поэтому нерегулярные структуры могут иметь различную конформацию.
ТРЕТИЧНАЯ СТРУКТУРА
Это трехмерная архитектура полипептидной цепи – особое взаимное расположение в пространстве спиралеобразных, складчатых и нерегулярных участков полипептидной цепи. У разных белков третичной структуры различна. В формировании третичной структуры участвуют дисульфидные связи и все слабые типы связей.
Выделяют два общих типа третичной структуры:
1) В фибриллярных белках (например, коллаген , эластин ) молекулы которых имеют вытянутую форму и обычно формируют волокнистые структуры тканей, третичная структура представлена либо тройной альфа-спиралью (например, в коллагене), либо бета-складчатыми структурами.
2) В глобулярных белках , молекулы которых имеют форму шара или эллипса (латинское название: GLOBULA - шар), встречается сочетание всех трех типов структур: всегда есть нерегулярные участки, есть бета-складчатые структуры и альфа-спирали.
Обычно в глобулярных белках гидрофобные участки молекулы находятся в глубине молекулы. Соединяясь между собой, гидрофобные радикалы образуют гидрофобные кластеры (центры). Формирование гидрофобного кластера вынуждает молекулу соответствующим образом изгибаться в пространстве. Обычно в молекуле глобулярного белка бывает несколько гидрофобных кластеров в глубине молекулы. Это является проявлением двойственности свойств белковой молекулы: на поверхности молекулы - гидрофильные группировки, поэтому молекула в целом - гидрофильная, а в глубине молекулы - спрятаны гидрофобные радикалы.
ЧЕТВЕРТИЧНАЯ СТРУКТУРА
Встречается не у всех белков, а только у тех, которые состоят из двух или более полипептидных цепей. Каждая такая цепь называется СУБЪЕДИНИЦЕЙ данной молекулы (или ПРОТОМЕРОМ ). Поэтому белки, обладающие четвертичной структурой, называют ОЛИГОМЕРНЫМИ белками. В состав белковой молекулы могут входить одинаковые или разные субъединицы. Например, молекула гемоглобина «А» состоит из двух субъединиц одного типа и двух субъединиц другого типа, то есть является тетрамером. Фиксируются четвертичные структуры белков всеми типами слабых связей, а иногда еще и дисульфидными связями.
МЕТОДЫ ОПРЕДЕЛЕНИЯ ПЕРВИЧНОЙ СТРУКТУРЫ БЕЛКА
1)Деградация по Эдмону
К раствору белка добавляют реактив Эдмона, содержащий фенилизотиоцианат.
Фенилизотиоцианат взаимодействует с альфа-аминогруппой первой (N-концевой) аминокислоты, а затем происходит ее отщепление от полипептидной цепи путем гидролиза:
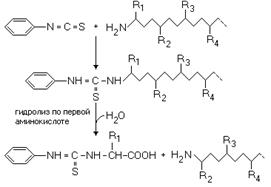
После этого идентифицируют первую аминокислоту. Затем процесс повторяется.
В настоящее время процесс автоматизирован.
2) Секвенирование ДНК
Первичная структура любой белковой молекулы напрямую зависит от структуры ДНК-генома. Поэтому сначала выделяют ген, в котором закодирована структура белка. Далее определяют последовательность азотистых оснований в ДНК. Каждая аминокислота в белковой молекуле закодирована сочетанием трех азотистых оснований - триплетом (кодоном) в молекуле ДНК. Например, сочетание трех оснований аденина (ААА) кодирует аминокислоту фенилаланин, а последовательность из трех оснований цитозина – глицин. Это дает возможность получить информацию о первичной структуре белковой молекуле, а, значит, прогнозировать строение всей молекулы в целом, поскольку именно первичная структура определяет строение всех высших уровней организации – и вторичной, и третичной, а, иногда и четвертичной структур.
Для проверки предположений о строении высших структур используется еще один метод:
3) Рентгеноструктурный анализ
Схема, поясняющая принцип этого метода, представлена на рисунке:
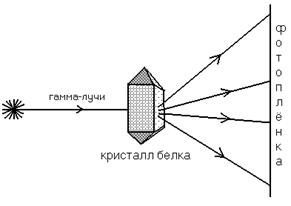
В результате облучения на фотопленке фиксируется карта электронной плотности (похожа на географическую карту). Далее производится компьютерный анализ полученного изображения, в результате чего строится пространственная модель белковой молекулы.