Реферат: Химия белка
5. Другие вещества, способные нарушать слабые типы связей в молекулах белков.
Воздействие факторами денатурации применяют для стерилизации оборудования и инструментов, а также как антисептики.
Обратимость денатурации
В пробирке (in vitro) чаще всего это – необратимый процесс. Если же денатурированный белок поместить в условия, близкие к нативным, то он может ренатурировать, но очень медленно, и такое явление характерно не для всех белков.
In vivo, в организме, возможна быстрая ренатурация. Это связано с выработкой в живом организме специфических белков, которые «узнают» структуру денатурированного белка, присоединяются к нему с помощью слабых типов связи и создают оптимальные условия для ренатурации. Такие специфические белки известны как «белки теплового шока » или «белки стресса ».
Белки стресса
Существует несколько семейств этих белков, они отличаются по молекулярной массе.
Например, известен белок hsp 70 – heatshock protein массой 70 kDa.
Такие белки есть во всех клетках организма. Они выполняют также функцию траспорта полипептидных цепей через биологические мембраны и участвуют в формировании третичной и четвертичной структур белковых молекул. Перечисленные функции белков стресса называются шаперонными . При различных видах стресса происходит индукция синтеза таких белков: при перегреве организма (40-440 С), при вирусных заболеваниях, отравлениях солями тяжелых металлов, этанолом и др.
В организме южных народов установлено повышенное содержание белков стресса, по сравнению с северной расой.
Молекула белка теплового шока состоит из двух компактных глобул, соединенных свободной цепью:

Разные белки теплового шока имеют общий план построения. Все они содержат контактные домены.
Разные белки с различными функциями могут содержать одинаковые домены. Например, различные кальций-связывающие белки имеют одинаковый для всех них домен, отвечающий за связывание Ca+2 .
Роль доменной структуры заключается в том, что она предоставляет белку большие возможности для выполнения своей функции благодаря перемещениям одного домена по отношению к другому. Участки соединения двух доменов – самое слабое в структурном отношении место в молекуле таких белков. Именно здесь чаще всего происходит гидролиз связей, и белок разрушается.
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ. РАСТВОРИМОСТЬ БЕЛКОВ В ВОДЕ
Большинство белков гидрофильны. Однако белковые молекулы имеют очень большие размеры, поэтому белки не могут образовывать истинных растворов, а только коллоидные. Внешнее проявление этого - это эффект Тиндаля (или конус Тиндаля). Эффект Тиндаля вызывается рассеянием тонкого пучка света при прохождении через белковый раствор. Несмотря на большую величину, многие белковые молекулы не осаждаются в водных растворах. Осаждению белковых молекул препятствуют факторы стабилизации белкового раствора.
ФАКТОРЫ СТАБИЛИЗАЦИИ БЕЛКА В РАСТВОРЕ
ГИДРАТНАЯ ОБОЛОЧКА - это слой молекул воды, определенным образом ориентированных на поверхности белковой молекулы. Поверхность большинства белковых молекул заряжена отрицательно, и диполи молекул воды притягиваются к ней своими положительно заряженными полюсами (смотрите рисунок).
Чем больше гидрофильных свойств у белковой молекулы, чем больше в ее составе и на ее поверхности аминокислот с полярными (гидрофильными) радикалами, тем сильнее выражена и прочнее удерживается гидратная оболочка и тем больше в ней слоев. Вода гидратной оболочки обладает особыми свойствами: она не является свободной, а связана с белковой молекулой. Это - “связанная” вода. Она принадлежит белку, и поэтому имеет особые свойства.
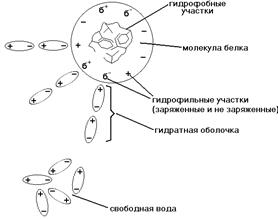
Свойства воды гидратной оболочки
а) Температура кипения выше 1000 С.
б) Температура замерзания ниже 0О С.
в) В воде гидратной оболочки не растворяются различные соли и другие гидрофильные вещества.
г) Окружая каждую молекулу белка, гидратная оболочка не дает этим белковым молекулам сблизиться, соединиться и выпасть в осадок.
2) ЗАРЯД БЕЛКОВОЙ МОЛЕКУЛЫ. Поверхность большинства белковых молекул заряжена потому, что в каждой молекуле белка есть свободные заряженные СОО- и NH3 + группы. Изоэлектрическая точка (ИЭТ) большинства белков организма находится в слабокислой среде. Это означает, что у таких белков количество кислотных (СООН) групп больше количества основных групп (NH3 ). рН плазмы крови около 7,36 - это выше ИЭТ большинства белков, поэтому в плазме крови белки имеют отрицательный заряд.
СПОСОБЫ ОСАЖДЕНИЯ БЕЛКОВ
Делятся на две группы:
1) Способы осаждения нативного белка
2) Способы осаждения денатурированного белка
Чтобы осадить белок из раствора, надо лишить его обоих факторов стабилизации: и заряда, и гидратной оболочки.
ОСАЖДЕНИЕ НАТИВНЫХ БЕЛКОВ