Реферат: Кинетическое уравнение Больцмана
![]()
![]()
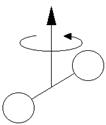
![]() Рассмотрим молекулу водорода (или любую другую двухатомную молекулу) при Т=300 К. Согласно закону равнораспределения на каждую степень свободы (поступательную, вращательную или колебательную) в среднем приходится одинаковая кинетическая энергия, равная .
Рассмотрим молекулу водорода (или любую другую двухатомную молекулу) при Т=300 К. Согласно закону равнораспределения на каждую степень свободы (поступательную, вращательную или колебательную) в среднем приходится одинаковая кинетическая энергия, равная .
![]()
![]() Пусть I - момент инерции молекулы, m - масса, d - среднее расстояние между атомами в молекуле.
Пусть I - момент инерции молекулы, m - масса, d - среднее расстояние между атомами в молекуле.
![]() - средняя кинетическая энергия вращения молекулы;
- средняя кинетическая энергия вращения молекулы;
![]()
![]()
(рад/c)
За одну секунду молекула делает (т.е. приблизительно ) полных оборота. Скорость изменения угла поворота оси двухатомной молекулы велика и все возможные ориентации молекулы в плоскости вращения будут равновероятными. Тогда при рассмотрении реальных физических задач функцию распределения можно считать не зависящей от ориентации молекулы. Закон равнораспределения справедлив и для многоатомных молекул, а значит сделанное предположение о независимости функции распределения от ориентации молекул газа в пространстве можно считать справедливым для многоатомных газов.
Колебательное движение атомов внутри молекулы практически всегда квантуется и состояние молекулы как квантовой системы должно определяться квантовыми параметрами. В обычных условиях (при не слишком высоких температурах) молекула газа находятся в невозбужденном состоянии, отвечающем основному (нулевому) колебательному уровню. Поэтому квантовыми эффектами в реальных газах при обычных условиях можно пренебречь. Следовательно, функция распределения классического идеального газа в неравновесном состоянии зависит не только от времени, но и от координат частиц .
![]()
![]()
![]() Обозначим символом Г совокупность всех переменных, от которых зависит функция распределения, за исключением координат молекулы и времени. В элементе фазового объёма выделим элементарный объём трёхмерного пространства , а остальную его часть обозначим символом dГ. Величины dГ есть интегралы движения, которые остаются постоянными для любой молекулы в течение её свободного движения между двумя последовательными столкновениями. Свободное движение молекулы осуществляется без внешнего воздействия со стороны каких-либо внешних тел или полей. В результате взаимодействия молекул друг с другом (в случае столкновении) или под воздействием поля
Обозначим символом Г совокупность всех переменных, от которых зависит функция распределения, за исключением координат молекулы и времени. В элементе фазового объёма выделим элементарный объём трёхмерного пространства , а остальную его часть обозначим символом dГ. Величины dГ есть интегралы движения, которые остаются постоянными для любой молекулы в течение её свободного движения между двумя последовательными столкновениями. Свободное движение молекулы осуществляется без внешнего воздействия со стороны каких-либо внешних тел или полей. В результате взаимодействия молекул друг с другом (в случае столкновении) или под воздействием поля
![]() эти величины вполне могут измениться. Координаты молекулы, как целого, меняются в течение её свободного движения.
эти величины вполне могут измениться. Координаты молекулы, как целого, меняются в течение её свободного движения.
![]()
![]()
![]()
![]()
![]()
![]()
![]() Концентрация или плотность пространственного распределения частиц газа может быть выражена интегралом , а среднее число частиц в элементе объёма определяется произведением . Под элементом объёма подразумевается физически малый объём , т.е. участок пространства, размеры которого малы по сравнению с размерами, рассматриваемыми в задаче. В то же время размеры малого объёма велики по сравнению с размерами молекул. Утверждение о нахождении молекулы в данном элементе объёма определяет положение молекулы в лучшем случае лишь с точностью до расстояний, превышающих размеры самой молекулы. Точное определение координат двух классических частиц даёт возможность точного определения их траекторий до и после столкновения, если оно имело место. Неопределенность же точного взаимного положения частиц даёт возможность применять вероятностный подход к решению задачи об их столкновении. Рассмотрение классического газа подразумевает то, что плотность
Концентрация или плотность пространственного распределения частиц газа может быть выражена интегралом , а среднее число частиц в элементе объёма определяется произведением . Под элементом объёма подразумевается физически малый объём , т.е. участок пространства, размеры которого малы по сравнению с размерами, рассматриваемыми в задаче. В то же время размеры малого объёма велики по сравнению с размерами молекул. Утверждение о нахождении молекулы в данном элементе объёма определяет положение молекулы в лучшем случае лишь с точностью до расстояний, превышающих размеры самой молекулы. Точное определение координат двух классических частиц даёт возможность точного определения их траекторий до и после столкновения, если оно имело место. Неопределенность же точного взаимного положения частиц даёт возможность применять вероятностный подход к решению задачи об их столкновении. Рассмотрение классического газа подразумевает то, что плотность
является макроскопической величиной. Макроскопичность имеет место лишь в том случае, когда элементарный объём содержит достаточно большое число частиц ( только тогда изменение числа частиц в элементарном объёме мало в течение рассматриваемого процесса); при этом линейные размеры области, занимаемой газом, должны быть значительно больше среднего межмолекулярного расстояния.
§2 Столкновение частиц.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() Рассмотрим столкновение молекул, одни из которых обладают значениями величин Г, лежащими в заданном интервале , а другие – в интервале . В результате столкновения молекулы приобретают значения величин Г в интервалах соответственно и . Далее для краткости будем говорить о столкновении молекул и с переходом
Рассмотрим столкновение молекул, одни из которых обладают значениями величин Г, лежащими в заданном интервале , а другие – в интервале . В результате столкновения молекулы приобретают значения величин Г в интервалах соответственно и . Далее для краткости будем говорить о столкновении молекул и с переходом
![]() Произведение числа молекул в единице объёма на вероятность каждой молекулы испытать столкновение с указанным переходом даст полное число таких столкновений, отнесённое к единице объёма в единицу времени. Вероятность такого события (обозначим её через некоторую функцию ) пропорциональна числу молекул в единице объёма и интервалам значений величин каждой из молекул после столкновения. Таким образом, будем считать, что , а число столкновений с переходом , происходящих в единице объёма в единицу времени примет вид
Произведение числа молекул в единице объёма на вероятность каждой молекулы испытать столкновение с указанным переходом даст полное число таких столкновений, отнесённое к единице объёма в единицу времени. Вероятность такого события (обозначим её через некоторую функцию ) пропорциональна числу молекул в единице объёма и интервалам значений величин каждой из молекул после столкновения. Таким образом, будем считать, что , а число столкновений с переходом , происходящих в единице объёма в единицу времени примет вид
![]()
![]()
![]()
![]()
![]() ( штрихом обозначены конечные состояния, без штриха - начальные). Вероятность столкновения обладает важным свойством, которое следует из законов механики, относительно обращения знака времени. Если обозначить верхним индексом Т значения всех величин, получившихся при обращении знака времени, то будет иметь место равенство
( штрихом обозначены конечные состояния, без штриха - начальные). Вероятность столкновения обладает важным свойством, которое следует из законов механики, относительно обращения знака времени. Если обозначить верхним индексом Т значения всех величин, получившихся при обращении знака времени, то будет иметь место равенство
![]()
![]()
![]() Обращение времени переставляет состояния “до” и ”после”, а значит необходимо переставить местами аргументы функции вероятности. В частности, указанное равенство справедливо в случае равновесия системы, т.е. можно утверждать, что в равновесии число столкновений с переходом равно числу столкновений с переходом (*) . Обозначим через равновесную функцию распределения и запишем
Обращение времени переставляет состояния “до” и ”после”, а значит необходимо переставить местами аргументы функции вероятности. В частности, указанное равенство справедливо в случае равновесия системы, т.е. можно утверждать, что в равновесии число столкновений с переходом равно числу столкновений с переходом (*) . Обозначим через равновесную функцию распределения и запишем
![]()
(1)
![]() Произведение дифференциалов представляет собой элемент фазового пространства, который не изменяется при обращении времени (дифференциалы в обеих сторонах равенства можно опустить) . Не изменяется так же потенциальная энергия молекул , и, следовательно, равновесная (больцмановская) функция распределения, которая зависит только от енергии :
Произведение дифференциалов представляет собой элемент фазового пространства, который не изменяется при обращении времени (дифференциалы в обеих сторонах равенства можно опустить) . Не изменяется так же потенциальная энергия молекул , и, следовательно, равновесная (больцмановская) функция распределения, которая зависит только от енергии :
![]() (2)
(2)
![]()
![]() V – макроскопическая скорость движения газа как целого. В силу закона сохранения энергии при столкновении двух молекул . Поэтому можно записать (3)
V – макроскопическая скорость движения газа как целого. В силу закона сохранения энергии при столкновении двух молекул . Поэтому можно записать (3)
![]() Отметим ещё тот факт, что сама функция вероятности в принципе может быть определена лишь путём решения механической задачи о столкновении частиц. Написанное выше равенства (1) , (2) и (3) дадут после сокращений в (1)
Отметим ещё тот факт, что сама функция вероятности в принципе может быть определена лишь путём решения механической задачи о столкновении частиц. Написанное выше равенства (1) , (2) и (3) дадут после сокращений в (1)
![]()
![]() С учётом утверждения (*)
С учётом утверждения (*)
![]() Интегрируя последнее равенство (для использования в дальнейшем) получаем соотношение:
Интегрируя последнее равенство (для использования в дальнейшем) получаем соотношение:
(4)
§3 ![]() Вывод кинетического уравнения.
Вывод кинетического уравнения.