Реферат: Клініко-імунохімічна оцінка ефекту захисту мозку при тяжкій черепно-мозковій травмі
Рис. 2Концентрація NSEу сироватці крові у перші 6 годин після тяжкої ЧМТ
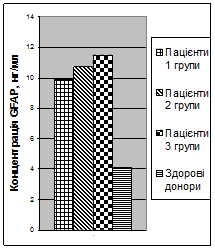
Рис. 3Концентрація GFAPу сироватці крові у перші 6 годин після тяжкої ЧМТ
Таким чином, протягом перших 6 годин тяжкої ЧМТ відзначався прорив ГЕБ з «виходом» у кров нейроспецифічних білків GFAPтаNSE, що є результатом значного первинного ушкодження нейронів та астроцитів. Нейронспецифічна енолаза може служити додатковим діагностичним критерієм тяжкості нейротравми.
При кількісному динамічному моніторингу концентрації GFAPу пацієнтів, що отримували стандартну терапію (1 група), були виявлені наступні зміни (рис. 5). У динаміці травматичної хвороби головного мозку концентрація GFAPпродовжувала зростати та досягала максимальних значень (23,0 ± 8,8 нг/мл, щов 5,6 раз перевищуєдонорський рівень) на 10-11 добу. Необхідно відзначити, що концентрація даного білка не досягала нормальних значень до кінця дослідження (13-15 доба). Цей факт можна пояснити з позицій розвитку реактивного астрогліозу, функцією якого є репарація та ізоляція зони ушкодження.
При кількісному динамічному моніторингу концентрації NSEу пацієнтів, що отримували стандартну терапію (1 група), були виявлені наступні зміни (рис. 4). На 2-3 добу відзначався значний підйом концентрації даного білка до 30,8 ± 5,1 нг/мл,що у 2,5 рази більше донорського рівня. У подальшому на 6-7 добу відзначалося достовірне (р = 0,005)зниження концентрації NSEдо рівня 18,8 ± 2,1 нг/мл. Нормалізація концентрації NSEвідзначалася на 13-15 добу посттравматичного періоду. Дана динаміка концентрації нейронспецифічної енолази відповідає концепції вторинних ішемічних ушкоджень головного мозку.
При кількісному динамічному моніторингу концентрації GFAPу пацієнтів, що отримували додатково до стандартної терапії L-лізину есцинат (2 група) були виявлені наступні зміни (рис. 5). На 2-3 та 6-7 добу концентрація даного білка складала 7,8 нг/мл та 11,4 нг/мл відповідно та була достовірно вище донорського рівня (p< 0,05) та достовірно нижче, ніж у пацієнтів 1 групи (p< 0,05). Це свідчить про здатність протинабрякового препарату L-лізіину есцинату зменшувати вторинну загибель астроцитів у період максимально вираженого набряку головного мозку та стабілізувати ГЕБ. У подальшому концентрація GFAPне відрізнялася від пацієнтів 1 групи та була достовірно вище донорського рівня (p< 0,05).
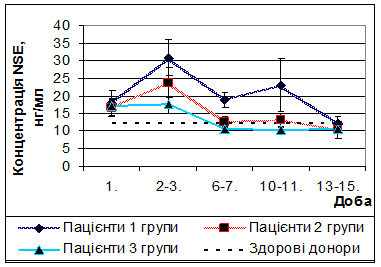
Рис. 4 Динаміка концентрації нейронспецифічної енолази у пацієнтів досліджуваних груп.
При кількісному динамічному моніторингу концентрації NSEу пацієнтів, що отримували додатково до стандартної терапії L-лізину есцинат (2 група) були виявлені наступні зміни (рис. 4). На 2-3 добу відзначався пік концентрації NSE(23,7 ± 4,1 нг/мл),проте на 23% менший, аніж у пацієнтів 1 групи.
Нормалізація концентрації NSEу сироватці крові пацієнтів 2 групи наступала на 6-7 добу, у той час, як у пацієнтів, що отримували стандартну терапію, вона досягала норми лише на 13-15 добу після травми. Це свідчить про здатність L-лізину есцинату у комплексі інтенсивної терапії тяжкої ЧМТ вже на 6-7 добу стабілізувати ГЕБ та зменшувати вторинні ушкодження нейронів.
При кількісному динамічному моніторингу концентрації GFAPу пацієнтів, що отримували додатково до стандартної терапії L-лізину есцинат та мексидол (3 група) були виявлені наступні зміни (рис. 5). На 2-3добу концентрація GFAPбула на 65,6% менше, аніж у пацієнтів 1 групи. У подальшому, на протязі всього періоду спостереження (з 2 до 15 доби), концентрація GFAPу пацієнтів 3 групи була нижче, ніж у пацієнтів 1 групи, та – на 13-15 добу – ніж у пацієнтів 2 групи, проте була вищою за донорський рівень. Це свідчить про здатність у комбінації L-лізину есцинату та мексидолу стабілізувати ГЕБ та зменшувати відстрочену загибель астроцитів.
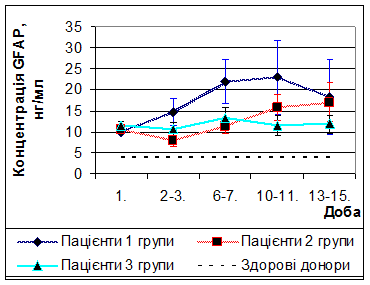
Рис. 5 Динаміка концентрації гліофібрилярного кислого протеїну у пацієнтів досліджуваних груп
При кількісному динамічному моніторингу концентрації NSEу пацієнтів, що отримували додатково до стандартної терапії L-лізину есцинат та мексидол (3 група), були виявлені наступні зміни (рис. 4). На 2-3 добу концентрація NSEу сироватці крові була достовірно (р < 0,05)вищою за донорський рівень та достовірно (р < 0,05)нижчою, аніж у пацієнтів 1 групи. На 6-7 добу концентрація NSEбула у межах норми та була достовірно (р < 0,05) нижчою, аніж у пацієнтів 1 групи. В подальшому концентрація NSEне підвищувалася. Відсутність підйому концентрації нейронспецифічної енолази на 2-3 добу у пацієнтів 3 групи, а також її швидка нормалізація свідчить про значний нейропротекторний ефект у комбінації L-лізину есцинату та мексидолу у комплексі інтенсивної терапії тяжкої ЧМТ.
Для клінічного аналізу ефективності запропонованих методів інтенсивної терапії тяжкої ЧМТ використовувались наступні параметри: динаміка рівня свідомості та тривалість ШВЛ у пацієнтів, що вижили, та летальність.
Рівень порушення свідомості оцінювався в балах шкали ком Глазго в динаміці травматичної хвороби головного мозку.
При надходженні рівень порушення свідомості у пацієнтів 1, 2 та 3 груп складав 7,0 ± 0,18 бала, 7,0 ± 0,16 бала и 6,8 ± 0,20 бала відповідно (табл. 1). На 2-3 добу рівень свідомості збільшився у пацієнтів 1 групи на 0,7 бала, у пацієнтів 2 групи на 1,1 бала та у пацієнтів 3 групи – на 1,3 бала. Дана динаміка корелювала з концентрацією нейронспецифічної енолази (- 0,43 > r> - 0,56). На6-7добу середній рівень свідомості у пацієнтів 1 групи підвищувався на 2 бали, в 2 групі – на 2,2 бали та в 3 групі - на 2,7 бали. Загалом під час спостереження у пацієнтів 1 групи свідомість відновилась на 4,6 бали, у пацієнтів 2 групи – на 4,8 бали, а у пацієнтів 3 групи – на 5,4 бали. Більш швидкий темп відновлення свідомості у пацієнтів 2 та 3 груп, порівняно з 1 групою, що корелює зі ступенем загибелі нейронів, вказує на ефективність оптимізованих методів інтенсивної терапії в профілактиці вторинних ішемічних пошкоджень.
Таблиця 1
Динаміка рівню свідомості (бали ШКГ) у пацієнтів досліджуваних груп, що вижили, M± m
|
1 доба |
2-3 доба |
6-7 доба |
10-11 доба |
13-15 К-во Просмотров: 201
Бесплатно скачать Реферат: Клініко-імунохімічна оцінка ефекту захисту мозку при тяжкій черепно-мозковій травмі
|