Реферат: Курсовая работа по органической химии
14) гидрохлорид аминоадамантана.
3.2. СИНТЕЗ 2`,3`-О-ИЗОПРОПИЛИДЕНАДЕНОЗИНА
0,4 г (1,5∙103 моль) аденазина высушивали в пистолете Фишера в течение 10-12 ч при 100 0 С (в парах толуола над пятиокисью фосфора) и готовили суспензию с 40 мл ацетона, добавляли 2 г (1,25∙10-2 моль) безводного сульфата меди и 0,01 мл концентрированной серной кислоты. Суспензию перемешивали 48 ч при 38 0 С. Осадок отделяли, промывали 2-3 раза небольшим количеством ацетона и объединенный фильтрат встряхивали в течение 1 ч с 0,4 г сухого гидроксида кальция. Осадок отфильтровывали и промывали ацетоном 2 раза по 10 мл. Фильтрат упаривали досуха. Выход продукта составил 0,21 г (52% от теоретического), белые кристаллы, t.пл. 218-220 0 С (лит 220-222 0 С) [26].
3.3. ПОЛУЧЕНИЕ 5`-Р-(ДИХЛОР)-2`,3`-О-ИЗОПРОПИЛИДЕНАДЕНОЗИНМОНОФОСФАТА
Охлаждали до 0 0 С раствор треххлористой окиси фосфора (0,15 мл) в триэтилфосфате (8 мл) добавляли 2`,3`-о-изопропилиденаденозина (0,75∙10-3 моль). Смесь выдерживали 24 ч при 4 0 С и затем нейтрализовали 25% водным раствором гидроксида аммония и оставляли на 1 ч при 4 0 С. Затем добавляли воду (20 мл), смесь экстрагировали бензолом (10 мл), а затем эфиром (2 х 10 мл). Водный слой отделяли, упаривали досуха и растворяли в воде (80 мл). Нуклеотид выделяем ионнообменной хроматографией на колонке (2,5 х 10 см), неподвижная фаза – Дауэкс-50 (Н+ ), роль подвижной фазы выполняет вода. Собирали частицы, поглощающие в УФ-области. Объединяли, упариваем досуха, соупаривали с 10% водным раствором гидроксида аммония (6 мл) растворяли в воде (10 мл) и подвергали сухой заморозке. Выход составил 0,126 г (60% от теоретического) [29].
3.4. СИНТЕЗ АМИНОАДАМАНТАНА
К водному раствору 1,87 г (1 моль) гидрохлорида аминоадамантана добавляли 0,40 г (1 моль) NaOH. Смесь экстрагировали эфиром (2 х 15 мл). Органический слой отделяли и выпаривали досуха. Выход аминоадамантана 1,83 г (98%), t.пл.=210 0 С.
3.5. СИНТЕЗ 5`-Р-(ДИАМИНОАДАМАНТИЛ)-2`,3`-О-ИЗОПРОПИЛИДЕНАДЕНОЗИНМОНО-ФОСФАТА
К полученному 5`-р-(дихлор)аденозинмонофосфату добавили 0,585 г раствора аминоадамантана в 2 мл абсолютного хлороформа. Осадок отфильтровывали. Фильтрат упаривали. Выход продукта составил 0,065 г (52% от теоретического).
4. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Синтез 2`,3`-о-изопропилиденаденозина осуществлялся взаимодействием аденозина с ацетоном в среде абсолютного ацетона при постоянном перемешивании. Схема этой реакции такова:
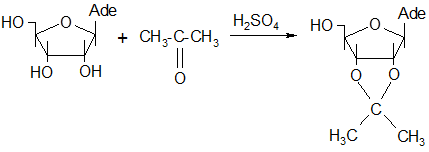
Предполагаемый механизм этой реакции следующий [29]:

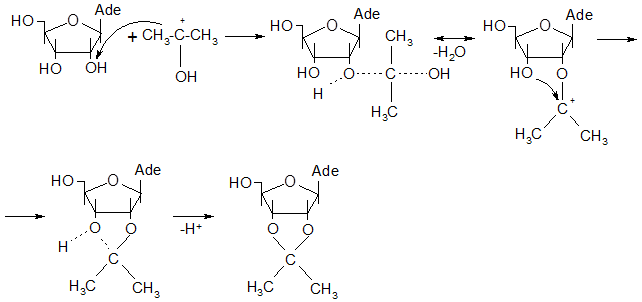
Синтез 5`-р-(дихлор)-2`,3`-о-изопропилиденаденозинмонофосфата осуществлялся взаимодействием 2`,3`-о-изопропилиденаденозина с треххлорокисью фосфора в присутствии водного раствора гидроксида аммония по следующей схеме:

Предполагаемый механизм этой реакции следующий:

Синтез аминоадамантана осуществлен реакцией нейтрализации гидрохлорида аминоадамантана гидроксидом натрия по следующей схеме:
![]()
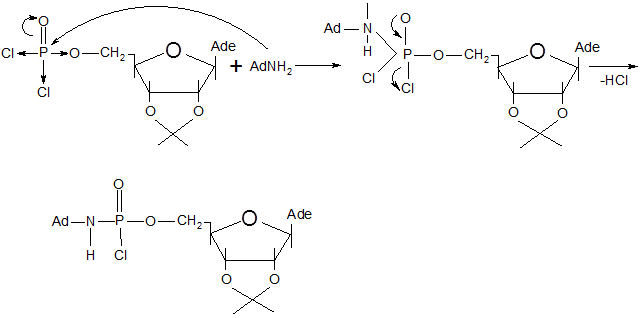
Синтез 5`-р-(диаминоадамантил)- 2`,3`-о-изопропилиденаденозинмоно-фосфата осуществлялся взаимодействием аминоадамантана с 5`-р-(дихлор)-2`,3`-о-изопропилиденаденозинмонофосфатом. Схема этой реакции такова:

Предполагаемый механизм этой реакции следующий [30]:

Чистота 5`-р-(диаминоадамантил)-2`,3`-о-изопропилиденаденозинмонофосфата была доказана методом ТСХ в системе бутанол : вода : уксусная кислота – 5:3:2 Rf =0,78 при УФ проявлении.
Наличие адамантильного остатка подтверждено ИК-спектроскопией. В ИК-спектре прослеживаются полосы, характерные для С-С (800 см-1 , 970 см-1 ), Н-С-С (1155 см-1 , 1350 см-1 ), Н-С-Н (1453 см-1 , 2853 см-1 ), С-С-С (2907 см-1 , 2933 см-1 ) адамантильного ядра и P-N (890 см-1 ).
5. ВЫВОДЫ
1. Показана принципиальная схема получения 5`-р-(диаминоадамантил)-2`,3`-о-изопропилиденаденозинмонофосфата взаимодействием аминоадамантана и 5`-р-(дихлор)-2`,3`-о-изопропилиденаденозинмонофосфата.
2. Чистота синтезированного соединения доказана методом ТСХ. Структура доказана методами ИК-спектроскопии.
6. СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
1. Касьян Л.И., Касьян А.О., Голодаева Е.А. // журн. органич. химии. 2000. т.36. №12. с. 1776-1779.
2. Багрин Е.И. Адамантаны: получение, свойства, применение. М.:Наука, 1989. 264 с.
3. Литвинов В.П. //Химия гетероциклических соединений. 2002. №1. с. 12-39
4. Морозов И.С., Петров В.И., Сергеева С.А. Фармакология адамантанов. Волгоград: Волгоградская мед. академия, 2001. 320 с.