Реферат: Микробиология дрожжевого производства
2. Бактерии, попадающие из аппаратуры, не всегда являются опасными, так как условия для их быстрого размножения не особенно благоприятны: кислая реакция среды, усиленная аэрация и т. д. Однако, если они имеются в большом количестве тогда влияние бактерий становится заметным.
Наиболее часто встречаются бесспоровые виды: лейконо-сток, флавобактерии, кишечная палочка, различные микрококки и др.
Приточная меласса является очень часто источником инфекции как бактериальной, так и дрожжевой. Обработанная таким образом меласса перекачивается насосами в сборники, а оттуда в приточные чаны. Разбавленная водой приточная меласса, содержащая от 18 до 40% сухих веществ, является очень хорошей питательной средой для размножения различных микроорганизмов. рН от 6,0 до 7,5, т. е. нейтральная или слабокислая реакция среды, является благоприятной для размножения бактерий, более кислая реакция (рН 3,5—4,5) задерживает их размножение. рН приточной мелассы зависит от способа ее осветления: при кислотнохолодном и кислотногорячем отстойных способах рН приточной мелассы 4,0—4,5; при механическом способе осветления мелассу подкисляют серной кислотой очень, слабо или совсем не подкисляют и рН раствора может колебаться в пределах от 6,5 до-8,0. Температурные пределы размножения бактерий от 15 до 45 °С. Чаще всего в приточной мелассе размножаются бактерии из группы кислотообразующих: Leuc. mesente-rioides и Leuc. agglutinans. Бактерии из группы спорообразующих: Вас. subtilis, Вас. mesentericus, Вас. megatherium — денитрификаторы, восстанавливающие до нитритов нитраты мелассы; при долгом стоянии приточной мелассы (более 24 ч) на поверхности жидкости иногда может образоваться пленка из дрожжеподобных грибков Candida Krusei.
Инфицированная приточная меласса представляет значительную опасность, так как в результате притока такой мелассы количество посторонних микроорганизмов в дрожжерастильном аппарате увеличивается, может появиться агглютинация — склеивание дрожжевых клеток в комки, в среде появляются нитриты (иногда и то, и другое вместе), посторонние дрожжевые грибки начинают усиленно размножаться в условиях аэрации. В результате нарушается нормальное течение технологического процесса выращивания дрожжей, снижается выход и качество продукции (рис. 4).
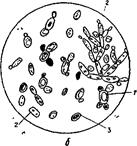
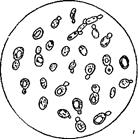
Рис. 4. Пробы содержимого дрожжерастильных аппаратов: а — нормально идущий процесс — почкование правильное, примесь посторонних дрожжей незначительная; б — неправильно идущий процесс, клетки угнетены, почкование неправильное (1), значительная примесь посторонних дрожжевых грибков (2), есть мертвые клетки, окрашенные метиленовой синью (3).
Засевные дрожжи в прессованном виде хранятся в холодильных камерах при 2—4°С в течение разных сроков: дрожжи чистой культуры до 1 месяца, а дрожжи естественной чистой культуры 3—4 суток. Засевные дрожжи, особенно дрожжи чистой культуры, не должны содержать посторонней микрофлоры. Однако часто засевные дрожжи становятся источником инфекции на заводе, особенно при удлиненных схемах выращивания дрожжей. Часто встречаются в засевных дрожжах дрожжеподобныё грибки Candida guaiermondii и Candida Krusei, причем особенно опасным является вид Candida Krusei. Этот, грибок, как известно, очень быстро размножается при аэрировании среды и количество клеток его сильно увеличивается и особенно быстро в стадии получения товарных дрожжей.
Бактериальная микрофлора засевных дрожжей чаще всего состоит из гетероферментативных молочнокислых бактерий Leuconostoc mesenterioides и Leuconostoc agglutinans, реже встречаются спорробразующие нитритообразователи — Вас. subtilis и Вас. mesentericus, а также Вас. proteus vulgare. При продолжительном хранении прессованных, дрожжей бактерии могут в них размножаться. Размножение Leuconostoc agglutinaus может вызвать агглютинацию — склеивание дрожжей в дрожжерастильных аппаратах.
4. МИКРОБИОЛОГИЧЕСКИЙ КОНТРОЛЬ ДРОЖЖЕВОГО ПРОИЗВОДСТВА
Микробиологический контроль осуществляется на всех стадиях производства хлебопекарных дрожжей, начиная с контроля сырья, поступающего на переработку, и кончая готовой продукцией.
Контроль сырья. Контроль микробиологической чистоты сырья имеет очень большое значение, поскольку при инфицировании процесса от сырья будут заражены все технологические стадии и фактически вся продукция будет забракована.
Меласса. В ней определяют общее количество микроорганизмов в 1 г., качественный (видовой) состав микрофлоры с целью выявления микроорганизмов — вредителей производства и их процентное соотношение, количественный состав.
Для определения общего количества микроорганизмов в 1 г. мелассы используют агаризованное мелассное сусло (с содержанием сухого вещества (СВ) 12% с дрожжевым автолизатом (СВ 0,5—1,0%), а для отдельных групп микроорганизмов — специальные и элективные среды. Общее количество микроорганизмов в 1 г. мелассы хорошего качества не должно превышать 2000; меласса считается непригодной, если в 1 г. содержится более 20000 микроорганизмов.
Для обнаружения молочнокислых бактерий в сусло добавляют стерильный мел. Молочнокислые бактерии определяют по прозрачным зонам, образующимся в результате растворения мела вокруг мелких круглых полупрозрачных колоний за счет выделения кислот. Лейконосток образует крупные, слизистые, легко растекающиеся прозрачные колонии, напоминающие капли воды с более слабой зоной просветления.
Гнилостные бактерии определяют на молочном агаре. Гнилостные бактерии обнаруживают по зонам просветления вокруг колоний за счет разложения казеина молока протеолитическими ферментами этих бактерий.
При содержании спорообразующих гнилостных бактерий 90% от общего количества микроорганизмов ее не следует использовать в дрожжевом производстве, так как среди них возможно присутствие нитритобразующих бактерий.
Определение нитритобразующей способности у спорообразующих бактерий осуществляют с использованием реактива Грисса. При наличии нитритов в среде, в которой развиваются эти бактерии, появляется красное окрашивание.
Минеральные соли и кукурузный экстракт. Обсеменённость минеральных солей микроорганизмами определяют путем микроскопирования. Допускается присутствие единичных клеток, но не в каждом поле зрения. Кукурузный экстракт контролируют микроскопированием или путем высева на питательные среды, используемые при анализе мелассы. Допускается заражение от 500 до 10000 микроорганизмов в 1 г. Более обсемененный экстракт может стать источником инфекции.
Контроль дрожжей на основных стадиях выращивания. Микробиологическому контролю подлежат дрожжи на всех стадиях размножения. В исходной чистой двухсуточной культуре перед ее разведением определяют: однородность дрожжевых клеток путем микроскопирования — все клетки должны быть одной применяемой расы дрожжей; чистоту культуры путем высева на плотную среду — посторонних дрожжей и бактерий не должно быть; ферментативную активность (зимазную и мальтазную) — она должна соответствовать показателям применяемой расы дрожжей.
На всех стадиях выращивания дрожжей (стадия ЧК, стадия ЕЧК и стадия товарных дрожжей) каждый час отбирают пробы и микроскопируют их (в 10 полях зрения). При этом отмечают количество почкующихся клеток (в %), правильность почкования, наличие мелких клеток, содержание мертвых клеток (%), присутствие посторонних дрожжей и бактерий. Количество почкующихся клеток колеблется от 10 до 80% в зависимости от момента взятия пробы. Количество мертвых клеток не должно превышать нескольких долей процента. Бактерии в посторонние дрожжи — несахаромицеты должны отсутствовать. Их не всегда удается обнаружить микроскопированием, поэтому проводят высев проб на две питательные среды: с антибиотиком нистатином, который подавляет рост дрожжей и позволяет выявить бактерии, и с ацетатом, на котором появление пленки или помутнение среды через 1—2 сут. указывает на наличие дрожжей-несахаромицетов (сахаромицеты на этой среде не размножаются).
Наличие посторонней микрофлоры свидетельствует о неудовлетворительном качестве дрожжей ЧК и ЕЧК и их непригодности для использования в качестве засевных при работе по удлиненным схемам. Появление пленки на поверхности среды или помутнение через 5 сут. и более дает основание считать, что культура чистая, не содержит посторонних дрожжей. Если пленка образовалась через 3—4 сут, то дрожжи ЧК и ЕЧК удовлетворительные.
В прессованных дрожжах ЧК и ЕЧК определяют: содержание влаги, кислотность (рН), зимазную и мальтазную активность, подъемную силу, ос нечувствительность.
Контроль готовой продукции. Прессованные дрожжи микроскопируют для оценки их качества по величине и однородности клеток сахаромицетов и с целью выявления посторонней микрофлоры. В случае резкого ухудшения подъемной силы или стойкости готовой продукции определяют степень ее общей обсеменённости и присутствие микроорганизмов — вредителей производства. Для этого производят посев пробы прессованных дрожжей на среды, используемые при контроле мелассы, и на сусло-агар для учета дрожжей-сахаромицетов.
Общее количество выросших колоний сахаромицетов принимают за 100% и затем рассчитывают процентное содержание посторонних микроорганизмов (кислотообразующих бактерий — лейконостока и молочнокислых палочек, гнилостных бактерий и несовершенных дрожжей). В доброкачественных прессованных дрожжах допускается присутствие кислотообразующих бактерий не более 15—35%, гнилостных бактерий быть не должно, посторонних дрожжей — не более 30%.
Показатели качества прессованных и сушеных хлебопекарных дрожжей. Они должны удовлетворять требованиям ГОСТа: иметь светло-серый или желтовато-белый цвет, характерный «дрожжевой» запах, слегка напоминающий фруктовый, консистенция должна быть плотной, дрожжи должны легко ломаться и не мазаться.
Содержание влаги в прессованных дрожжах должно быть не более 75%, зольность — не выше 2%.
Основным показателем качества хлебопекарных дрожжей является их подъемная сила. Подъемная сила должна быть не более 75 мин.
В прессованных дрожжах, поступающих на сушку, определяют содержание влаги и подъемную силу, количество несовершенных дрожжей. Желательно, чтобы подъемная сила была до 60 мин. После сушки в сушеных дрожжах определяют содержание влаги, подъемную силу, кислотность, а также оценивают цвет, запах дрожжей и определяют количество мертвых клеток.