Реферат: Одно и многоатомные спирты
1. Кислотные и основные свойства спиртов.
CH3 -OH + HNO3 ¨ CH3 -ONO2 + H2 O
CH3 CH2 OH + H2 SO4 ® CH3 CH2 OSO3 H + H2 O
CH3 CH2 OH + (CH3 CO)2 O ® CH3 COOC2 H5 + CH3 COOH
Это – реакции замещения водорода на кислотный остаток.
2. Замещение гидроксильной группы на галоген.
CH3 CH2 OH + HBr « CH3 CH2 Br + H2 O
Реакция протекает по механизму нуклеофильного замещения.
CH3 CH2 -OH + SOCl2 ® CH3 CH2 -Cl + SO2 + HCl
3CH3 CH2 -OH + PCl3 ® 3CH3 CH2 -Cl + H3 PO4
Ниже приводится механизм взаимодействия спирта с тионилхлоридом:
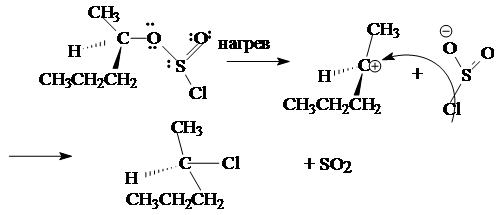
Этот механизм обозначается символом Sni (замещение нуклеофильное внутримолекулярное).
Реакции отщепления
CH3 CH2 OH ® CH2 =CH2
В качестве катализаторов используют минеральные кислоты (серная, фосфорная), кислые соли (KHSO4 ), ангидриды кислот (Р2 О5 ), оксид алюминия и т.д.
R-OH + R’-OH ® ROR (ROR’, R’OR’) + H2 O
Порядок отщепления воды в большинстве случаев определяется
правилом зайцева : при отщеплении воды наиболее легко отщепляет водород от соседнего наименее гидрированного атома углерода.
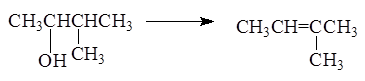
Реакция отщепления воды от спиртов протекает через стадию образования карбкатиона:
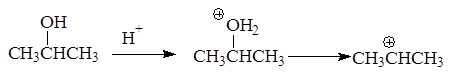
В зависимости от строения спирта образуются первичные, вторичные и третичные карбкатионы:
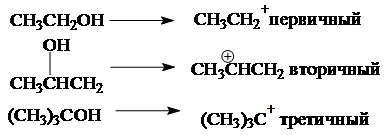
По увеличению стабильности катионы располагаются в следующий ряд: CH3 CH2 + < CH3 CH+ CH3 < (CH3 )3 C+
Любое влияние, делокализующее положительный заряд карбкатиона, ведет к его стабилизации. Мы имеем дело в данном ряду с индукционной стабилизацией:
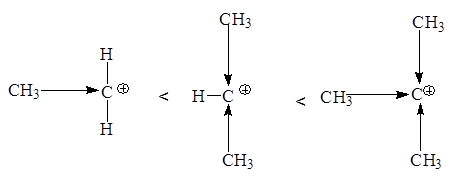
Образующиеся катионы в зависимости от их строения способны к перегруппировкам: