Реферат: Одноосновные насыщенные карбоновые кислоты
Компоненты карбоксильной группы имеют следующие названия:
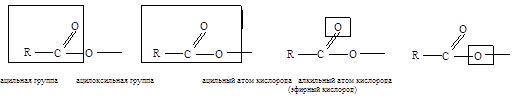
Кислотные радикалы RCO- (ацилы) имеют следующие названия:
| радикал муравьиной кислоты | формил | HCO- |
| радикал уксусной кислоты | ацетил | CH3 CO- |
| радикал пропионовой кислоты | пропионил | CH3 CH2 CO- |
| радикал масляной кислоты | бутирил | CH3 CH2 CH2 CO- |
| радикал валериановой кислоты | валерил | CH3 CH2 CH2 CH2 CO- |
Промышленные способы получения карбоновых кислот
1. Окисление углеводородов
Имеются два направления: окисление низших алканов С4 -С8 преимущественно в уксусную кислоту и окисление твердого парафина в так называемые синтетические жирные кислоты (СЖК) с прямой цепью углеродных атомов С10 -С20 , являющихся сырьем для синтеза ПАВ.
Процесс протекает в жидкой фазе - термически или в присутствии катализаторов. При окислении алканов происходит деструкция по связям между вторичными углеродными атомами, поэтому из н-бутана образуется главным образом уксусная кислота, а в качестве побочных продуктов - метилэтилкетон и этилацетат.
2. Синтезы на основе оксида углерода
Карбоновые кислоты получают на основе оксида углерода реакциями карбоксилирования и карбонилирования:
CH2 =CH2 + CO + H2 O ® CH3 CH2 COOH
CH3 CH2 OH + CO ® CH3 CH2 COOH
Присоединение водорода и карбоксильной группы по двойной связи при кислотном катализе всегда протекает по правилу Марковникова, вследствие этого только из этилена получается неразветвленная кислота, а из его гомологов - a-метилзамещенные кислоты. Особый интерес данный метод представляет для синтеза третичных кислот (неокислот) из изоолефинов (реакция Коха):
(CH3 )2 C=CH2 + CO + H2 O ® (CH3 )3 CCOOH
изобутилен триметилуксусная кислота
Механизм реакции состоит в предварительном протонировании алкена кислотой с образованием иона карбония, его взаимодействия с СО с получением ацилий-катиона и реакции последнего с водой с образованием карбоновой кислоты:
RCH=CH2 + H+ « RC+ HCH3 + CO « RCH(CH3 )C+ O + H2 O « RCH(CH3 )COOH + H+
Неокислоты и их соли обладают очень высокой растворимостью и вязкостью, а их сложные эфиры - стабильностью к гидролизу, что обеспечивает им широкое применение в ряде отраслей.
Карбонилирование спиртов катализируется комплексами металлов (Ni, Co, Fe, Pd). Процесс реализован в промышленности для синтеза уксусной кислоты из метанола и характеризуется высокими экономическими показателями.
Кислоты также получают окислением альдегидов (продукт оксосинтеза).
Лабораторные способы получения карбоновых кислот
1. Окисление первичных спиртов см. Лекцию№21
2. Окисление альдегидов и кетонов
Альдегиды окисляются значительно легче, чем кетоны. Кроме того, окисление альдегидов приводит к образованию кислот с тем же числом углеродных атомов, в то время как окисление кетонов протекает с разрывом углерод-углеродных связей (образуются две кислоты или кислота и кетон):
CH3 CHO + O2 ® CH3 COOH + H2 O
CH3 CH2 COCH2 CH3 + O2 ® CH3 COCH3 + CH3 CH2 COOH
Окислителями служат перманганат калия или бихромат. Окисление кетонов требует более жестких условий, чем альдегиды.
3. Гидролиз нитрилов
Нитрилы получают взаимодействием галогеналканов с цианистым калием, а затем подвергают их гидролизу водными растворами кислот или щелочей. В кислой среде азот выделяется в виде соли аммония:
CH3 CN + 2 H2 O + HCl®CH3 COOH + NH4 Cl
R-CºN+H+ ®R-C+ =NH+H2 O®RC(O+ H2 )=NH«H+ + RC(OH)=NH«RCONH2
RCONH2 + HX + H2 O ® RCOOH + NH4 X;
в щелочной - в виде гидроксида аммония, кислота же получается в виде соли:
CH3 CN + 2 H2 O + KOH®CH3 COOK + NH4 OH
RCºN + - OH®RC(OH)=N- + H2 O® -OH + RC(OH)NH«RCONH2 + NaOH®RCOONa + NH3
4. Синтез Гриньяра
При взаимодействии магнийорганических соединений с диоксидом углерода образуются соли карбоновых кислот:
CH3 CH2 MgBr + CO2 ®CH3 CH2 COO- Mg+ Br
--> ЧИТАТЬ ПОЛНОСТЬЮ <--