Реферат: Основы термодинамики
«Первый закон термодинамики, как и закон сохранения энергии в механике, часто дает возможность исследовать тепловые процессы в макроскопических системах даже в тех случаях, когда нам не известны детали микроскопической картины изучаемых явлений.
Первый закон универсален, он применим ко всем без исключения тепловым процессам в любых системах. Как и всякий закон сохранения, он не дает детальной информации о ходе процесса, но позволяет составить уравнение баланса, если заранее известно, какие энергетические превращения происходят в рассматриваемой системе.
Сделаем несколько замечаний о смысле входящих в уравнение первого закона величин. Количество переданной теплоты было определенно как мера изменения внутренней энергии системы при теплопередаче. Но не всегда подведение к системе теплоты приводит к изменению ее внутренней энергии. Например, при изотермическом расширении идеального газа подведение теплоты не сопровождается увеличением внутренней энергии газа. Внутренняя энергия идеального газа зависит только от температуры и при изотермическом процессе не меняется, но газ совершает работу, и величина этой работы равна подводимому к системе количеству теплоты.
Совершение внешними силами механической работы над системой также может не сопровождаться изменением ее внутренней энергии. Если сжимать идеальный газ, принимая меры к тому, чтобы его температура при этом не увеличивалась, то внутренняя энергия газа останется без изменения, а окружающим телам перейдет некоторое количество теплоты, равное совершенной над газом при его сжатии работе»[1] .
«Применение первого закона термодинамики к процессам в одноатомных идеальных газах
1. Изотермический процесс (Т = const):
![]()
При изотермическом процессе обмен энергией между идеальным газом и окружающими телами происходит и в форме теплопередачи, и в форме работы. Все подведенное к идеальному газу тепло затрачивается на совершение работы.
Если газ получает теплоту (Q > 0), то он совершает положительную работу (А` > 0), если газ отдает теплоту (Q < 0), то А` < 0. Работа внешних сил над газом в этом случае положительная (А > 0).
2. Изобарический процесс (р = const):
![]()
При изобарическом процессе обмен энергией между идеальным газом и окружающими телами происходит в форме работы и теплопередачи. Сообщенная идеальному газу теплота затрачивается и на изменение внутренней энергии, и на совершение газом работы:
![]()
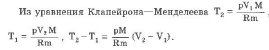
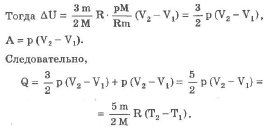
3. Изохорический процесс:
При изохорическом процессе обмен между идеальным газом и окружающими телами происходит только в форме теплопередачи. Вся подведенная к идеальному газу теплота затрачивается на изменение его внутренней энергии:
![]()
4. Адиабатический процесс (Q = 0):
Адиабатический процесс - процесс, при котором физическая система не получает теплоты извне и не отдает ее. Этот процесс протекает без теплообмена с окружающими телами.
При адиабатическом процессе:
![]()
При адиабатическом процессе обмен энергией между идеальным газом и окружающими телами происходит только в форме работы. Работа при адиабатическом процессе совершается за счет изменения внутренней энергии газа.
Если А` > 0 (газ расширяется), то дельта U < 0 - температура газа понижается. Если же А` < 0 (газ сжимается), то дельта U > О - температура повышается»[2] .
«Змеевик как тепловая машина. Посмотрим как происходит протекание газа через змеевик. Если в змеевике газ охлаждается, т.е. отдает теплоту (Q<0), то совершаемая работа над газом положительна – внешние силы «проталкивают» газ через змеевик. Если теплота подводится к газу (Q>0), то наш змеевик подобен тепловой машине – газ сам совершает работу над внешними телами. Этот результат не зависит от того, какова величина давления газа на выходе и на входе. Единственное условие при этом – давление на входе должно быть больше давления на выходе, иначе газ просто потечет в обратную сторону.
Попробуем при помощи компрессора прокачивать через змеевик газ в вакуум. Для того чтобы процесс можно было считать стационарным, сечение выходного отверстия нужно сделать много меньше сечения входного. Змеевик теплоизолируем от окружающей среды.
Совершаемая компрессором над газом работа положительна и равна полной совершаемой над газом работе, ибо, выходя за вакуум, газ работы не совершает. Так как нет обмена теплотой, налицо противоречие с утверждением о том, что при адиабатическом протекании работа равна нулю.
Это противоречие возникло потому, что при прокаичвании газа в вакуум происходят и такие энергетические превращения, которые были совершенно несущественны. Действительно, первый закон термодинамики использовался в виде Q + A = U, где U – внутренняя энергия газа. Поэтому при использовании такой формулировки первого закона термодинамики заранее молчаливо предполагается, что в рассматриваемых процессах не происходит изменения механической энергии системы, т.е. не меняется потенциальная энергия газа как целого во внешнем поле, не меняется и кинетическая энергия движения газа как целого, не возникает в газе никаких макроскопических потоков. Теперь уже становится ясно, что при прокачивании газа в вакуум возникает макроскопический направленный поток, кинетическую энергию которого необходимо учитывать. Работа компрессора в этом случае как раз и определяет кинетическую энергию этого потока.
Если вход и выход змеевика расположены на разной высоте, то в уравнении закона сохранения энергии необходимо учитывать и изменение потенциальной энергии газа в поле тяжести, подобно тому как это делалось в гидродинамике при выводе уравнения Бернулли»[3] .
Список использованной литературы:
1) Бутиков Е.И., Кондратьев А.С., Уздин В.М. Физика. Строение и свойства вещества. М. – С.-П., ФИЗМАТЛИТ.
2) Учебник «Физика-10» В.А.Касьянов , М., Дрофа, 2003.
3) http://www.fizika.asvu.ru/page.php?id=34 - Первый закон термодинамики - закон сохранения энергии для систем, в которых существенную роль играют тепловые процессы
Реферат
по дисциплине Концепции современного естествознания
на тему:
«Первое начало термодинамики».
«Термодинамика – это раздел физики, изучающий общие закономерности обмена тепловой энергии между системами, системой и внешней средой и производства работы за счет этой энергии».[4]
--> ЧИТАТЬ ПОЛНОСТЬЮ <--