Реферат: Основы термодинамики
Раствор HCl в бензоле электрической проводимостью не обладает, следовательно, в данном растворе отсутствуют ионы, т.е. не происходит диссоциации. Водный же раствор хлороводорода содержит ионы Н+ и Сl- , хотя газообразный HCl представляет собой молекулу с полярной ковалентной связью.
При воздействии диполей воды полярная связь в HCl еще больше поляризуется и в конце концов происходит ионизация молекулы HCl:
HClН+ + Сl-
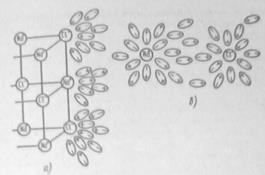
Рис.1. Распад кристаллов хлорида натрия на отдельные ионы под влиянием диполей воды:
а – открытых отдельных ионов; б – гидратированные ионы натрия и хлора в растворе
Далее ион водорода Н+ присоединяется к атому кислорода в молекуле Н2 О по донорно-акцепторному механизму. Пару электронов для образования связи поставляет атом кислорода. Следовательно, суммарно диссоциацию HCl можно изобразить уравнением:
HCl + Н2 О Н3 О+ + Сl-
Образующийся ион Н3 О+ называется гидроксонием»[12] .
«Стрелки показывают, что процесс идет в двух направлениях: наряду с диссоциацией молекулы на два иона идет обратный процесс рекомбинации (воссоединения) ионов в нейтральную молекулу.
Положительные ионы, движущиеся к катоду, называются катионами, отрицательные – анионами, т.е движущиеся к аноду.
Заметим, что если молекулы растворенного вещества не диссоциируют на ионы, то раствор не является проводником. Примером могут служить водные растворы сахара и глицерина, которые являются хорошими изоляторами»[13] .
Степень диссоциации. Факторы, влияющие на степень диссоциации
«Поведение водных растворов электролитов в химических реакциях во многом зависит от того, насколько полно они распадаются на ионы. Для количественной оценки диссоциации важное значение имеют параметры, как степень и константа диссоциации.
Степень диссоциации а – это отношение числа молекул, распавшихся на ионы, к исходному числу молекул растворенного вещества:
![]()
Степень диссоциации иногда выражаю в процентах:
![]()
Степень диссоциации электролитов зависит от концентрации растворов: с понижением концентрации уменьшается взаимодействие ионов в растворе, которое приводит к образованию молекул, поэтому степень диссоциации возрастает. По степени диссоциации электролиты принято делить на сильные, слабые и средние. Сильные электролиты имеют а > 30%; слабые – а < 3%; средние - а в пределах от 3 до 30%.
К сильным электролитам в водных растворах относятся почти все соли, большинство неорганических кислот (HNO3 , HCl, H2 SO4 , HClO4 и др.), а также гидроксиды щелочных и щелочноземельных металлов. Средними электролитами являются H2 SO3 , H3 PO4 и др. такие соединения, как H2 S, Cu(OH)2 и др. являются слабыми электролитами.
Деление электролитов на слабые, средние и сильные носит условный характер, так как степень диссоциации зависит от природы электролита и растворителя, от концентрации и температуры раствора. Водные растворы различных солей, кислот и оснований одной и той же концентрации в разной степени диссоциируют на ионы. На степень диссоциации существенно влияет присутствие одноименных ионов в растворе. Так, если в растворе имеется CuCl2 , то равновесие системы
CuCl2 ![]() Cu2+ + 2Cl-
Cu2+ + 2Cl-
Можно сдвинуть влево путем увеличения концентрации ионов Cu2+ илиCl- . Это достигается добавлением к раствору электролита, содержащего один из этих ионов»[14] .
«Процессом, противоположным электролитической диссоциации является молизация – воссоединение ионов противоположных знаков в нейтральные молекулы. Если между процессами диссоциации и молизации существует динамическое, подвижное состояние, то а находится из уравнения:
![]()
При ![]() имеем
имеем ![]() , т.е. в слабых растворах почти все молекулы диссоциированы. С ростом концентрации раствора а убывает. В сильных концентрированных растворах
, т.е. в слабых растворах почти все молекулы диссоциированы. С ростом концентрации раствора а убывает. В сильных концентрированных растворах
![]() »[15] .
»[15] .
Необычные электролиты
Встречаются весьма и необычные электролиты. Например, электролитом является стекло, представляющее собой сильно переохлажденную жидкость, обладающую громадной вязкостью. При нагревании стекло размягчается и его вязкость сильно уменьшается. Присутствующие в стекле ионы натрия Na+ приобретают заметную подвижность, и становится возможным прохождение электрического тока, хотя при обычных температурах стекло является хорошим изолятором.
Наглядной демонстрацией этого может служить опыт, схема которого показана на рис.2.