Реферат: P-V-T соотношения: реальный газ и идеальный газ
Механическое состояние вещества в отличие от термодинамического можно описать при наличии известных величин давления, температуры и объема. Эти три параметра связаны между собой уравнением состояния ![]() , поэтому только два из них являются независимыми. Уравнение состояния соответствующего вида может применяться для оценки многих важных свойств чистых веществ и их смесей. Например, для прогнозирования плотности жидкой и паровой фаз, давления пара, критических свойств смесей, равновесия “жидкость-пар”, отклонений энтальпии и энтропии от идеального состояния.
, поэтому только два из них являются независимыми. Уравнение состояния соответствующего вида может применяться для оценки многих важных свойств чистых веществ и их смесей. Например, для прогнозирования плотности жидкой и паровой фаз, давления пара, критических свойств смесей, равновесия “жидкость-пар”, отклонений энтальпии и энтропии от идеального состояния.
В настоящее время не существует такого уравнения состояния, которое было бы применимо для оценки этих свойств любого органического вещества. На данный момент известно более 150 эмпирических уравнений состояния. Они получены на основе обработки экспериментальных P-V-T-данных, сведений по эффекту Джоуля-Томпсона или данных о теплоемкости реальных газов при различных температурах и давлениях. По степени сложности вся совокупность уравнений состояний может быть разделена на некоторые группы. В данном пособии рассматриваются в сопоставлении уравнения состояния каждой группы, широко применяемые при массовых расчетах. Приводятся также сведения, представляющие исторический интерес.
Начало исследований, посвященных изучению количественных соотношений между давлением, объемом и температурой, положено экспериментами Бойля (1662 г.), в результате которых он пришел к выводу, что при данной температуре объем газа обратно пропорционален его давлению.
Количественное выражение температурного воздействия было установлено Шарлем и Гей-Люссаком (1802 г.), которые обнаружили линейный характер этого отношения.
В 1801 г. Дальтон сформулировал закон парциальных давлений, согласно которому в смеси каждый газ ведет себя так, как если бы он один занимал весь объем. При этом общее давление смеси равно сумме парциальных давлений компонентов.
Парциальным давлением компонента называется то давление, которое оказывал бы газ, входящий в смесь, если бы из нее были удалены остальные газы при условии сохранения первоначальных объема и температуры.
В 1822 г. Каньяр де ля Тур открыл критическое состояние вещества.
В 1834 г. Клапейрон объединил законы Шарля и Бойля и впервые сформулировал закон идеальных газов.
Еще на первоначальном этапе исследований было обнаружено, что закон идеальных газов зачастую дает лишь приблизительное описание реального газа. Эти отклонения объяснялись тем, что молекулы имеют конечный объем и между ними существуют силы межмолекулярного взаимодействия.
В 1873 г. Ван-дер-Ваальс предложил уравнение, в котором количественно учтены оба этих фактора, определены условия сосуществования жидкой и паровой фаз и критическое состояние системы. Уравнение Ван-дер-Ваальса положено в основу многих современных уравнений состояния.
1880 г. - Амага сформулировал закон, который гласит, что объем смеси компонентов представляет собой сумму объемов этих компонентов, каждый из которых находится при температуре и давлении смеси.
1901 г. - Льюис ввел понятие фугитивности.
1927 г. - Урселл вывел, используя методы статистической механики, вириальное уравнение состояния.
В 50-х гг. XX столетия началось активное внедрение принципа соответственных состояний в практику прогнозирования многих свойств органических соединений. Развитие теории по вопросам описания свойств газов и жидкостей продолжается.
Идеальный газ
Понятие “идеальный газ” характеризует чисто гипотетическое состояние вещества. P-V-T соотношение для одного моля идеального газа описывается уравнением Менделеева-Клапейрона:
![]() .(4.1)
.(4.1)
Изотермы идеального газа в системе координат P-V представляют собой гиперболы, что иллюстрируется примером 4.1.
Пример 4.1
Для идеального газа показать зависимость P-V-T при температуре 500, 657 и 1170 К и объеме 100-3000 см3/ моль.
Решение
При 500 К и 100 см3/ моль имеем: ![]() = 82,06·500/100 = 410 атм.
= 82,06·500/100 = 410 атм.
При выражении давления в физических атмосферах, температуры в К, объема в см3/моль R = 82,06 (см3·атм)/(моль·К).
Фрагмент результатов расчета приведен в табл. 4.1 и на рис. 4.1.
Таблица 4.1
Давление идеального газа при T, К
| V, см3/моль | P, атм при температуре Т, К | ||
| 500 К | 657 К | 1170 К | |
| 700 | 59 | 77 | 137 |
| 800 | 51 | 67 | 120 |
| 900 | 46 | 60 | 107 |
| 1000 | 41 | 54 | 96 |
| 2000 | 21 | 27 | 48 |
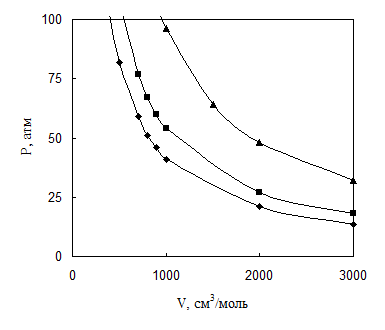
Рис. 4.1. P-V соотношения идеального газа
Реальное состояние вещества
Степень отклонения свойств веществ, находящихся в реальном состоянии, от свойств идеального газа зависит от температуры и давления системы, а также от природы вещества. При высоких давлениях плотность паровой фазы может значительно превышать плотность жидкой фазы. Так, при 1500 МПа и 338 К плотность газообразного водорода составляет 130 кг/м3, тогда как плотность жидкого водорода равна 70 кг/м3, а твердого - 80 кг/м3. При плотности 1500 кг/м3 и температуре, превышающей критическую, фактический молярный объем азота в 16 раз больше молярного объема, рассчитанного по уравнению для идеальных газов.
Реальные газы отличаются от идеальных также характером изменения их теплофизических свойств. Теплоемкость идеального газа не зависит от давления, но на реальные газы это правило не распространяется. Вблизи критической точки многие свойства реальных газов изменяются аномально.
Силы, действующие между молекулами, а следовательно, и характер P-V-T функции, определяются тем, какими атомами представлена молекула, их взаимным расположением, а также размерами и формой самой молекулы. На молекулы действуют одновременно силы притяжения и отталкивания. Действие сил притяжения проявляется сильнее с увеличением расстояния между ними, отталкивания - с его уменьшением. Силы притяжения ведут к проявлению давления большей величины, чем давление, создаваемое кинетической энергией молекул, в то время как силы отталкивания уменьшают эффективный объем, доступный для молекулярного движения.
--> ЧИТАТЬ ПОЛНОСТЬЮ <--