Реферат: Получение фенолов
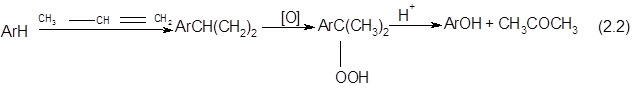
Этот метод является в настоящее время основным промышленным методом производства фенола (вместе с ацетоном). Метод начинает использоваться в крупном промышленном масштабе для синтеза дикрезольной смеси (через изопропилтолуолы) и двухатомных фенолов резорцина и гидрохинона (через дигидроперекиси соответствующих диизопропилбензолов). Являясь универсальным способом синтеза фенолов, гидроперекисный метод после соответствующей доработки может быть применен для синтеза ксиленолов (через гидроперекиси соответствующихизопропилксилолов) и β-нафтола (через гидроперекись β-изопропилнафталина).
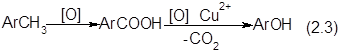 |
????????????? ??????????????????? ?????????????? ??????, ?????????? ??? ????????? ??????????????? ?????????????????? ?????????????.
Этот метод применяется в промышленном масштабе для получения фeнoлa из толуола через промежуточное окисление последнего до бензойной кислоты По-видимому, метод может представить интерес и для синтеза крезолов, исходя из ксилолов, однако для реализации этого варианта процесса необходима организация производства толуиловых кислот и отработка методов превращения последних в крезолы.
Классическим методомсинтеза фенолов является щелочное плавление сульфокислот ароматических углеводородов
???? ????? ?? ??? ??? ?????????? ??? ????????? ?????? ? β- ??????? ?? ??????? ? ????????? ??????????????. O?, ??-????????, ???????? ???????????? ??? ???????????? п- ??????? ?? ??????? ? ? ???? ???????? ?????????? ? ???? ?????. ???? ??? ??????????????? ????? ???????? ???????? ??? ???????????? ????????? ?? ???????. ??? ?????? ????????? ???????? ?????????? ??? ??? ??????? ???? ?????????????? ?????????? ?? ????????.
Синтез фенола из хлорбензола щелочным гидролизом или гидролизом в присутствии катализаторов хотя и не находит дальнейшего развития, но применяется в достаточно крупном промышленном масштабе.
В последнее время для синтеза фенола из бензола и особенно α-нафтола из нафталина в промышленном масштабе используют метод, основанный на гидрировании ароматического углеводорода до соответствующего циклоалкана, окислении последнего в смесь карбинола и кетона и получении при их дегидрировании фенолов.
 |
? ???????? ???????? ????????? ??????? ?????????? ????????????????, ?????????? ?? ????????????? ??????. ????? ???????????? ??????????????? ?????????? ????????????? ????????????? ? ?????????????? ???????????? ????????????????.
Метод находит ограниченное применение в производстве малотоннажных продуктов.
 |
????? ????????????? ??? ???????????? ????????? ????????? ????? ???? ???????????? ?????????? ??????. ???????? ?????? ? ???????????? ???????? ?????????? ????????????? ?????? ????????? ??? ???????? (??????? ??????? ?????????).
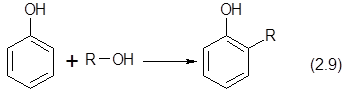 |
???? ????? ???????? ???????? ??? ??????? ????????? ??????????????? ? ?????? ????????????? ????????????, ? ????? о -??????? ? 2,6 ?????????.
Вместо метанола возможно алкилирование формальдегидом. Образующееся метилольное производное переводится в метилфенол через промежуточное образование Шиффова основания.
 |
Из-за сложности и многостадийности этот метод промышленного применения не нашел.
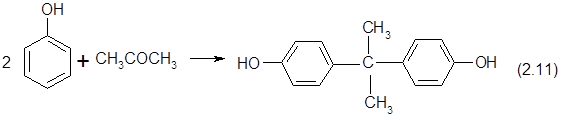 |
?????? ???????????? ? ?????????????? ? ???????????? ??????????? ??????? ???????????? ??????? ? ???????? ? ??????????????? ??? ????????? ???????????????? ?? ?????? ? ???????:
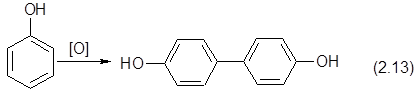 |
???????, ????????? ? ?????? ?????????? ????? ??????? ??????????? ???????, ?????????? ?? ????????? ?????? ? ??????????? ???????? ?????????? ??????????? ??? ???????????? ????????????? ??????????? ???????:
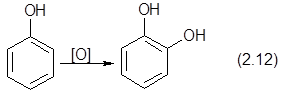 |
Перспективы промышленной реализации этого метода пока неясны.
Рассмотрим критерии, которыми можно руководствоваться при выборе способа синтеза фенолов. Такими критериями могут быть прежде всего низкая себестоимость получаемою продукта и его высокое качество, малое число стадии технологического процесса, небольшое количество вредных сточных вод и выбросов, которые достаточно просто могут быть ликвидированы, доступность исходных реагентов и высокая селективность процесса. Эти требования зачастую противоречивы, и в большинстве случаев приходится выбирать оптимальное соотношение всех показателей.
Часто за оптимальный показатель принимают одностадийность процесса, что не всегда оправдано. Эта рекомендация не редко вступает в резкое противоречие с овальными показателями. Так, в настоящее время, единственный одностадийный процесс получения фенолов прямое окисление углеводородов ряда бензола не применяется, а многостадийный процесс получения фенола через кумол (изопропилбензол) в силу своей экономичнocти получил широкое промышленное распространение.
При переходе к гомологам фенола выбор возможных методов синтеза усложняется. Получение ряда веществ, например о -крезола, невозможно, если использовать в качестве исходного сырья о -изопропилтолуол. Смесь м -крезола и n -крезола проще всего получать кислотным разложением гидроперекисей соответствующих изопропилтолуолов, а чистый п- крезол наиболее рационально готовить щелочным плавлением п -толуолсульфокислоты. о- Крезол легко синтезировать алкилированием фенола метанолом или окислительным декарбоксилированием м -толуиловой кислоты.
2.2 Получение фенолов щелочным плавлением сульфокислот
Щелочное плавление сульфокислот ароматических углеводородов — один из старейших способов приготовления фенолов. Он и сейчас вызывает определенный интерес из-за относительной дешевизны реагентов, а также высоких выходов целевых продуктов. Для синтеза ряда изомерных крезолов, ксиленолов, замещенных нафтолов — это пока единственный возможный способ производства. Важно и то, что на всех стадиях синтеза, кроме сульфирования, не наблюдается изомеризация. Таким образом, состав получаемых замещенных фенолов полностью определяется условиями сульфирования.
В настоящее время имеется ряд промышленных установок по производству фенола (единичные мощности до 20-30 тыс. т в год), β-нафтола, резорцина, п -крезола (единичные мощности до 5-10 тыс. т в год) сульфурационным методом. По аналогичной технологии может быть налажено промышленное производство ксиленолов. Выпуск отдельных партий их осуществляется и в настоящее время.
Синтез фенолов слагается из ряда стадий, общая схема представлена на рис. 2.1. Рассмотрим особенности технического оформления и химизм различных стадий этого процесса.

Рис. 2.1. Схема получения фенолов щелочным плавлением сульфокислот.
2.2 .1. Щелочное плавление сульфокислот
При щелочном плавлении сульфокислот замещение сульфогруппы на оксигруппу считают результатом сложного процесса, предполагающего промежуточное присоединение щелочи по кратной связи:
 |
Кроме этого основного процесса возможно также прохождение и других, ведущих к образованию побочных продуктов, в частности протекает расщепление сульфонов с образованием фенолятов и частично дифенола:
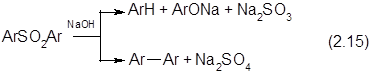 |
Возможно взаимодействие сульфокислот и фенолятов с образованием дифениловых эфиров:
???????, ???????? ????????? ??????????? ?????? ??? ????????? ????????? ??????? ? ???????????? ???????????????, ????????????? ? ?? ?????????.
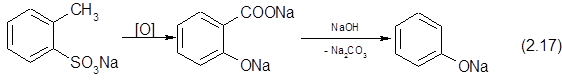 |
??? ???????? ????????? ???????????? ????????? ??????? ? ????????? ?????????? ????? ????????? ????????? ????? ? ???????????? ????????? ? ????????????? ????? ? ?????, ?????? ?? ?????????? ????????????? ?????:
Так, пpи щелочном плавлении толуолсульфокислоты образуется заметное количество фенола (от 1—1,5% при исключении кон тактов плава с воздухом до 15-20% — в случае интенсивного перемешивания плава). При щелочном плавлении сульфокислот ксилолов при температурах выше 350о С количество фенола и крезолов в плаве может достигать 15-25% от общего количества фенолов. По литературным данным, при использовании над плавом подушки из инертного газа и времени контакта 1,5 ч выход крезолов составляет 92%, тогда как в отсутствие инертного газа только 60 70%.
Для уменьшения потерь фенолов при окислении плава применяются различные способы изоляции плава от атмосферы — чаще всего за счет применения подушки из перегретого водяного пара или инертных газов. Однако даже при изоляции от воздуха в плаве возможно прохождение — тем более при высоких температурах — окислительно-восстановительных процессов, например:
приводящих к образованию оксидифенилов и тиофенолятов. Правда, глубина их не очень велика, однако они приводят не только к увеличению количества примесей вообще, но и к появлению трудноотделимых от фенолов тиофенолов.
На выход фенолов и развитие побочных процессов серьезное влияние оказывают примеси солей. По данным Беркмана, присутствие 2% хлорида натрия в плаве уменьшает выход фенола при плавлении на 3- 4%, присутствие 0,5% солен железа сокращает выход фенола на 3—4%. Последнее объясняется окислительным действием ионов железа при высоких температурах.
Сульфат натрия в количестве до 10% незначительно влияет на процесс щелочного плавления Это позволяет не выделять из сульфонатов серную кислоту при небольшом (до 5-6%) ее содержании.
Па процесс щелочного плавления определенное влияние оказывает вид применяемой щелочи. Так, в промышленности чаще используют более дешевый и доступный едкий натр. В лабораторных условиях чаще применяют едкое кали, в котором лучше растворяются соли сульфокислот. Это обстоятельство имеет особое значение для щелочного плавления сульфокислот гомологов бензола, соли которых в щелочи растворяются значительно хуже, чем соли бензолсульфокислоты. В связи с этим было предложено брать для проведения плавления смесь щелочей, содержащую не менее 28% едкого кали, или плавить толуол сульфонат в присутствии бензолсульфоната.
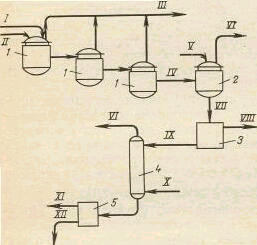 |
?????? ????????????? ????? ?????????????????? ?????? ????? ?????? ????????????? ??????? ??????. ??? ????????? ??????? ?????? ?????????? ?????? ?????? ????, ??????? ????????????
Рис 2.2. Принципиальная технологическая схема щелочного плавления арилсульфонатов (непрерывная схема с каскадом плавильников)
Аппараты: 1 - обогреваемые плавильники; 2— аппарат для разбавления ("гашения") плава; 3 - фильтр для выделения сульфита натрия; 4 — скруббердля выделения фенолов из фенолятов; 5 - отстойник.