Реферат: Получение оксидов урана
Операции превращения этих соединений в конечные продукты показаны на схеме:
![]() UO2 (NO3 )2 . 6H2 O Упарка
UO2 (NO3 )2 . 6H2 O Упарка
![]() (NH4 )2 U2 O7 UO3
(NH4 )2 U2 O7 UO3
![]()
![]()
![]() ПрокаливаниеВосстановление UO2
ПрокаливаниеВосстановление UO2
![]()
![]() UO4 . 2H2 O U3 O8
UO4 . 2H2 O U3 O8
(NH4 )4 [UO2 (CO3 )3 ]
![]()
![]()
![]() U Металлотермия Обработка HF
U Металлотермия Обработка HF
![]() UF4
UF4
![]() UF6 Фторирование
UF6 Фторирование
Следовательно, оксиды урана UO3 , UO2 и U3 O8 – важнейшие промежуточные продукты уранового производства при получении фторидов урана и металлического урана.
Кроме того, основой ТВЭЛов современных ядерных реакторов многих типов служит диоксид урана, который обладает высокой коррозионной и радиационной стойкостью. Применение огнеупорного UO2 дает возможность получать в реакторах значительно более высокие температуры, чем при использовании обычных металлических ТВЭЛов. Для изготовления таких ТВЭЛов используют, как правило, диоксид урана, обогащенный изотопом уран-235. Химические свойства такого диоксида аналогичны обычному. К диоксиду, обогащенному изотопом уран-235, предъявляются повышенные требования как по чистоте, так и по структуре и физическим свойствам [1].
Система «уран–кислород». Оксиды урана
Система «уран – кислород» представляет собой одну из самых сложных двойных систем. Три оксида урана – диоксид UO2 , закись-окись U3 O8 и триоксид UO3 известны уже более ста лет. Исследования последних лет показали, что возможно существование монооксида UO, а также таких соединений урана с кислородом, как U4 O9 ,U3 O7 ,U2 O5 и что эти соединения, как и три ранее известных оксида, не являются стехиометрическими, и в действительности существует разнообразие нестехиометрических форм. Было показано существование в системе U–O нескольких фаз (табл. 1).
Таблица 1. Возможные фазы в системе «уран–кислород»
| Фазы | Плотность, г/см3 |
| UO | 13,63 |
| UO2 | 10,96 |
| U4 O9 | 11,16 |
| U3 O7 | ___ |
| U3 O8 | 8,39 |
| a-UO3 | 8,34 |
| b-UO3 | 7,15 |
При изучении системы «уран–кислород» обнаружено несколько гомогенных областей с переменным составом урана и кислорода. Одна из таких областей лежит, например, между составами UO2 – UO2,25 . Существование стабильной фазы монооксида урана не доказано.
Монооксид урана. Низший оксид урана встречается только в видетонких пленок на уране или включений в металл. Это хрупкое вещество серого цвета с металлическим блеском. По различным данным, его плотность составляет 13,6 – 14,2 г/см3 . Монооксид имеет кубическую решетку типа NaCl. По мнению некоторых исследователей, при обычных условиях в свободном состоянии UO не существует. Основная трудность ее получения связана с тем, что она устойчива только при высоких температурах. [1]
Диоксид урана UO2 (точнее, UO2 ± Х ) – вещество темно-коричневого цвета с кристаллической структурой типа CaF2 . Это нестехиометрическое соединение может иметь состав от UO1,6 до UO2,25 , причем дополнительные (сверх стехиометрии) атомы кислорода удерживаются в промежутках кристаллической решетки в результате внедрения атомов кислорода в решетку UO2 типа флюорита.
Диоксид урана может быть получен восстановлением триоксида или U3 O8 водородом или оксидом углерода при 500–600°С. Он образуется также при окислении урана на воздухе при 150 –170°С. Это – основной оксид, которому соответствует основной гидроксид U(OH)4 . Диоксид урана термодинамически устойчив при нагревании в вакууме или в восстановительной атмосфере до 1600°С и возгоняется без разложения. При более высокой температуре он теряет кислород с образованием достехиометрического диоксида. В присутствии кислорода UO2 способен растворять его в себе с сохранением кубической структуры, образуя фазу UO2+ x , где х зависит от температуры.
Диоксид урана не реагирует с водой и ее парами до 300°С, нерастворима в соляной кислоте, но растворима в азотной кислоте, царской водке и смеси HNO3 и HF. При растворении в азотной кислоте происходит образование уранил-ионов UO2 2+ . Известен один кристаллогидрат диоксида урана UO2 . 2H2 O – черный осадок, выпадающий при гидролизе растворов урана (IV). Диоксид урана входит в состав уранового минерала уранинита.
Оксиды U4 O9 и U3 O7 образуют самостоятельные фазы нестехиометрического состава. Для оксида U3 O7 характерно наличие метастабильных тетрагональных фаз. Существует по крайней мере пять таких фаз, которые при температуре выше 600°С распадаются с образованием соответственно UO2 и U4 O9 или U4 O9 и UO2,6 . При температуре выше 600°С в системе U–O в области от U4 O9 до U3 O8 исчезают все метастабильные тетрагональные оксиды, и в равновесии находятся фаза U4 O9 и фаза с ромбической структурой закиси-окиси.
Закись-окись урана U3 O8 – нестехиометрическое соединение, имеющее несколько модификаций в зависимости от условий приготовления. Цвет вещества – от зеленого до оливково-зеленого и черного. Закись-окись образуется при окислении на воздухе диоксида урана и при прокаливании на воздухе до красного каления (650–900°С) любого оксида урана, гидрата оксида или соли урана и летучего основания или кислоты.
Оксид U3 O8 рассматривают иногда как UO2 . 2UO3 на основании того, что при растворении его в растворе присутствуют U4+ и 2UO2 2+ . Однако доказано, что все атомы урана в U3 O8 структурно эквивалентны и несут равный средний положительный заряд ![]() .
.
Закись-окись урана нерастворима в воде и разбавленных кислотах, но медленно растворяется в концентрированных минеральных кислотах с образованием смеси солей урана и уранила. В HCl и H2 SO4 образуется смесь урана в степенях окисления четыре и шесть, а в HNO3 – только уранил-ион. При неполном растворении U3 O8 в серной кислоте образуется U2 O5 , которая не получается при восстановлении оксидов урана водородом при нагревании.Закись-окись имеет гидрат U3 O8 . x H2 O, который не кристаллизуется и очень легко окисляется до гидрата триоксида урана. Значение триоксида велико и потому, что она входит в состав смоляной руды – настурана.
Триоксид урана UO3 – один из промежуточных продуктов в производстве чистых солей урана, встречающихся также в некоторых окисленных урановых рудах.
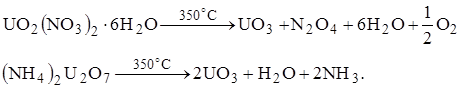 |
UO3 ? ????????-?????? ???????, ???????????? ? ????? ???????? ? ???? ??????????????? ??????, ?????????? 5,92 ? 7,54 ?/??3 . ?? ???????????????? ???????? ?? ??????? ?? ??????????? 600??. ???????? ????? ???????? ?????????? UO2 ??? U3 O8 ?????????? ??? ???????? 30 ? 100 ???. ? ??????????? ????? 500??; ????????????? ??????? ???????? ????? UO4 . 2H2 O; ???????????? ????????????? UO2 (NO3 )2 . 6H2 O ??? ????????? ??????? (NH4 )2 U2 O7 :
Триоксид урана амфотерен: с кислотами он образует соли уранила, например, UO2 SO4 , со щелочами – соли урановой кислоты, например, Na2 U2 O7 . Известно несколько кристаллогидратов триоксида урана, которые можно рассматривать как кислоты.
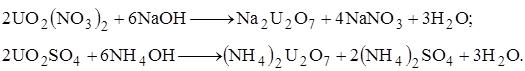 |
? ?????????? ?????? ????????? ??????? ??????????????? ????????? ????? ?? ????????? ? ???? ?????????? (??? ????????????):
Пероксид урана UO4 . n H2 O существует только в форме гидратов с 2, 3, 4 и 4,5 молекулами воды. Его можно представить как комплекс UO2 (O2 )x x n H2 O. Он может быть получен действием пероксида водорода на соединения UVI и UIV в азотнокислом растворе. Пероксид урана – нерастворимое соединение, с помощью которого уран можно отделить от всех элементов, кроме тория, плутония, нептуния, циркония и гафния. Пероксид урана обладает кислотными свойствами. [1,2]
Технологическая характеристика оксидов урана
Оксиды урана имеют весьма важное значение в технологии производства ядерного горючего. В некоторых типах гетерогенных ядерных реакторов основой тепловыделяющих элементов (ТВЭЛов) является диоксид урана, который обладает высокой коррозионной и радиационной устойчивостью. Его огнеупорность дает возможность получать в ядерных реакторах очень высокие температуры и увеличивать тем самым коэффициент полезного действия. Кроме того, совместимость диоксида урана с различными материалами оболочки и его высокая плотность также с положительной стороны характеризуют этот вид ядерного горючего.
Из диоксида урана ТВЭЛы могут быть изготовлены в виде брусков, трубок, таблеток и т. д. обычными методами керамической технологии: холодным прессованием и выдавливанием с последующим спеканием изделий или горячим прессованием. В виде порошка диоксид урана диспергируется в металлических, графитовых или керамических матрицах.
Но, пожалуй, еще большее значение оксиды урана имеют как промежуточные продукты при производстве других соединений урана и главным образом фторидов. Наконец, нельзя не отметить, что оксиды урана как наиболее устойчивые его соединения могут быть использованы для целей хранения урана и послужить промежуточным звеном между урановорудным, аффинажно-металлургическим и фторидными производствами.
В связи с указанными выше областями применения оксидов урана к ним предъявляются совершенно определенные требования. Необходимо, чтобы оксиды урана были кондиционными по содержанию примесей. В том случае, если имеется в виду самостоятельное применение оксидов урана в гомогенных или гетерогенных ядерных реакторах, содержание примесей в них должно быть весьма малым, соответствующим требованию ядерной чистоты продуктов (табл. 2).
Таблица 2. Спецификация ядерно-чистого диоксида урана,
изготовленного на заводе Порт-Хоуп (Канада)
Элемент | Максимально допустимое содержание, части на миллион частей урана |
| Ag | 1 |
| B | 0,2 |
| Cd | 0,2 |
| Cr | 10 |
| Cu | 10 |
| Fe | 50 |
| Mn | 5 |
| Mo | 1 |
| Ni | 15 |
| Si | 20 |
| Dy | 0,1 |
| Gd | 0,05 |
Если же оксиды урана являются промежуточными продуктами в производстве, например, фторидов урана, содержание примесей в них определяется целым рядом различных факторов.
Если же оксиды урана служат промежуточным звеном от уранового производства к аффинажно-металлургическому, по содержанию примесей они должны удовлетворять кондициям на технические продукты (несколько процентов примесей).
Другое важное требование, предъявляемое к оксидам урана, связано с их химическим составом, соотношением урана и кислорода, валентной формой урана. Из всех оксидов урана наиболее целесообразно применять в гетерогенных ядерных реакторах оксид урана стехиометрического состава UO2,00 , так как для него характерна наибольшая теплопроводность, наименьший рост зерна при спекании и выделение минимального количества осколочных элементов во время облучения. Однако в этом случае не следует применять такие теплоносители как вода и углекислота, которые при высоких температурах будут окислять диоксид стехиометрического состава.
III. МЕТОДЫ ПОЛУЧЕНИЯ ОКСИДОВ УРАНА
Производство оксидов урана из уранилнитрата
Получение оксидов урана из уранилнитрата основано на процессе термической диссоциации соли (шестивалентного гидрата) при повышенной температуре:
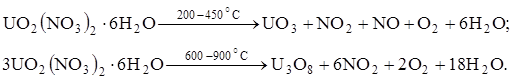 |
???? ??????? (???. 1) ???????? ???????? ???????????????? ? ??????????????? ???????? ???, ? ????? ?????? ? ??????. ???????? ?? ????????? ????????, ?? ???????? ?????????? ??????, ??? ??? ?????????? ???????? ?????????? ??????? ?????? ??????? ?? ??????? ???????????? (???????????, ???????? ?? ???????, ??????? ? ?. ?.), ? ??? ????? ??? ??????????? ?????? ???????????????? ????????.
Раствор уранилнитрата В атмосферу или
![]()
![]()
![]()
![]()
|
Гексагидрат уранилнитрата