Реферат: Психология и физиология сна
Эксперименты на лабораторных животных показали, что если в бодрствовании, в состоянии тонической деполяризации, характер разрядов отдельных клеток коры мозга высоко индивидуализирован, то по мере углубления сна он коренным образом изменяется – близлежащие нейроны начинают «хором» разряжаться. При этом условия для переработки информации в мозге резко ухудшаются. Эти измерения хорошо отражают известные данные об отключении сенсорных систем и постепенном торможении психической активности по мере углубления сна у человека.
Если состояние нервных клеток во время бодрствования можно описать как состояние тонической деполяризации, то обычный, или ортодоксальный, сон (а в данном случае речь идет именно о нем) является состоянием «тонической гиперполяризации» – направление перемещения основных ионных потоков, формирующих потенциал мембраны нейрона и участвующих в проведении нервного импульса (катионов натрия, калия, кальция, анионов хлора), а также важнейших макромолекул меняется в этом случае на противоположное. Таким образом, в состоянии сна происходит восстановление мозгового гомеостаза, нарушенного в ходе предшествующего многочасового бодрствования.
Это означает подтверждение старого, как мир, но почему-то забытого правила: без хорошего сна не может быть хорошего бодрствования. Периоды тонической деполяризации и гиперполяризации должны периодически сменять друг друга для сохранения постоянства внутренней среды головного мозга и обеспечения нормального функционирования коры – субстрата высших психических функций человека.
Процесс постепенного «углубления» наступившего обычного сна развивается до определенного предела – пока не срабатывает некий «переключатель» и вся система не перебрасывается в другое состояние. Таким состоянием может быть либо пробуждение, либо наступление фазы парадоксального сна.
У большинства животных периоды сна и бодрствования на протяжении суток сменяют друг друга несколько раз, и в этом случае наступление фазы парадоксального сна обычно предшествует пробуждению. У человека периоды обычного и парадоксального сна в норме несколько раз подряд сменяют друг друга без наступления пробуждения.
Первое описание этого состояния – состояния «сна с быстрыми движениями глаз» – было сделано почти полвека назад американским физиологом Н.Клейтманом и его аспирантами Ю.Азеринским и В.Дементом. Позже огромный вклад в изучение этого явления внес Мишель Жуве. Ему же принадлежит сама формулировка понятия «парадоксальный сон».
В отличие от обычного сна сон парадоксальный имеет ярко выраженную активную природу. В этом состоянии в мозг не поступает информация от «входов» (органов чувств) и не подается информация на «выходы» (мышечную систему), однако клетки мозга проявляют чрезвычайную активность.
Получается не сон и не бодрствование, а, согласно Жуве, особое – третье – состояние организма, характеризующееся действительно парадоксальным сочетанием признаков внешнего покоя с чрезвычайно высокой активацией мозга и переживанием сновидений – как бы активное бодрствование, направленное внутрь. Открытие парадоксального сна и описание связанных с ним явлений совершило настоящую революцию в науке и изменило все представления человечества о природе сна.
Исследования позволили предположить, что в этом состоянии интенсивно перерабатывается та информация, которая была получена и сохранена в памяти в период предшествующего бодрствования. Кроме того, согласно гипотезе М.Жуве, во время парадоксального сна каким-то образом происходит переброска в нейрологическую память элементов наследственно закрепленных (инстинктивных) схем поведения. Подтверждением этому служат эмоционально окрашенные сновидения у человека, а также обнаруженный М.Жуве со своими сотрудниками и детально исследованный американским ученым Э.Моррисоном феномен демонстрации переживаемых сновидений кошками – после разрушения одной крошечной точки в задней части мозга, снимающей двигательное торможение в состоянии парадоксального сна, можно по характеру движений вполне представить себе, что именно кошка «видит» и что она «делает» во сне (охотится за мышью, убегает от собаки, дерется с соперниками и т.п.).
Запускается парадоксальный сон, как теперь установлено, из четко очерченного центра, расположенного в задней части мозга, в области варолиева моста и продолговатого мозга. Химическими передатчиками сигналов расположенных в этом «центре парадоксального сна» клеток служат ацетилхолин и глутаминовая кислота.
В 1980-е годы было обнаружено, что в парадоксальном сне те нейроны активирующих систем мозга, которые выделяют передатчики ацетилхолин и глутамат (они расположены в ретикулярной формации ствола и базальных ядрах переднего мозга), чрезвычайно активны, а нейроны, выделяющие в качестве химических передатчиков моноамины (норадреналин, серотонин и гистамин) выключаются и «молчат».
Этот факт определяет физиологическое различие между бодрствованием и парадоксальным сном, а на психическом уровне – различие между нашим восприятием внешнего мира и восприятием мира воображаемого, мира сновидений (рис. 2).
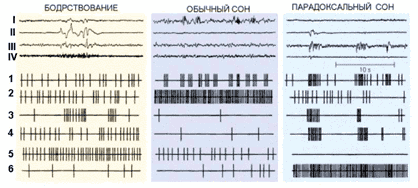
Рис. 2. Суммарная электрическая активность (I–IV) и активность одиночных нейронов (1–6) в цикле сон–бодрствование у кошки: I – кора больших полушарий, II – глаза, III – таламус, IV – мышцы шеи; 1– нейроны коры и таламуса, 2 – нейроны преоптической области переднего гипоталамуса, выделяющие гамма-аминомасляную кислоту, 3 – нейроны ретикулярных ядер моста, 4 – нейроны зрительной системы, 5 – активирующие нейроны, выделяющие моноамины (норадреналин, серотонин, гистамин), 6 – нейроны, расположенные в «центре парадоксального сна»
Регуляторы сна
Таким образом, об исполнительных механизмах трех функциональных состояний мозга – бодрствования, обычного сна и парадоксального сна – известно уже довольно много. Практически неизвестным, однако, остается биохимический механизм, управляющий чередованием этих состояний. На эту роль требуются вещества, обладающие более длительным сроком жизни в организме, чем «классические» нейропередатчики, менее специфичные по отношению к конкретным белкам-рецепторам, способные переноситься током ликвора (спинномозговой жидкости) и распространяться по межклеточной жидкости, оказывая воздействия на обширные области в мозге, иногда довольно удаленные от места выброса. Такие вещества стали известны сравнительно недавно – это регуляторные пептиды, продукты прицельного расщепления белков, эволюционно древние передатчики, широко распространенные в мозге и организме и играющие важную роль в целом ряде физиологических процессов.
Из них в первую очередь обращает на себя внимание так называемый «Дельта-Сон индуцирующий пептид» (ДСИП) – единственное вещество, выделенное из крови кроликов группой швейцарских авторов еще в конце 70-х годов как регулятор сна. В исследованиях введение этого вещества подопытным животным не давало соответствующего эффекта – возможно, в силу быстрого распада его молекул под воздействием ферментов организма. Однако ученым удалось обнаружить «снотворные» свойства у некоторых производных ДСИП – так называемых «структурных аналогов», которым химическим путем была придана повышенная устойчивость к разрушающим ферментам. Такие вещества представляют определенный интерес для дальнейшего фармакологического изучения, тем более что есть основания предполагать у них и способность усиливать сопротивляемость организма стрессорным воздействиям.
Интересно, однако, что некоторые особенности ДСИП вызывают сомнение в его природном происхождении. Этот пептид не входит ни в одно из многочисленных ныне известных пептидных семейств. Не удалось обнаружить ни его рецептора, ни гена, кодирующего белок-предшественник, из которого выщепляется ДСИП, ни самого этого белка. Возникает предположение: не является ли этот пептид своего рода артефактом, результатом ошибки в установлении аминокислотной последовательности молекулы при его выделении в ничтожных количествах (0,3 мг)? Проверить эту гипотезу не представлялось возможным вплоть до 1998 года, когда с помощью пептидного банка EROP-MOSCOW, созданного доктором биологических наук А.А. Замятниным, сотрудником Института биохимии РАН, удалось случайно обнаружить структурное сходство ДСИП и одного из дерморфинов – природных пептидов, впервые выделенных в начале 80-х годов из кожи (дермы) лягушек и обладающих сильнейшими опиоидными (морфиноподобными) свойствами.
Тогда и были разработаны структурные последовательности молекул двух таких пептидов (аналогов и ДСИП, и дерморфина одновременно) – совершенно идентичных, но являющихся оптическими изомерами. Затем эти пептиды были синтезированы в НИИ химии при Санкт-Петербургском университете. При введении в мозг подопытным кроликам один из этих пептидов оказался абсолютно неактивным, зато другой, обладающий повышенной устойчивостью по отношению к разрушающему действию ферментов мозга, продемонстрировал сильнейший эффект, заключавшийся в значительном увеличении и длительности обычного сна – как за счет уменьшения времени бодрствования, так и за счет сокращения периода сна парадоксального.
Характер этого «снотворного» эффекта очень напоминал эффект активных аналогов ДСИП, но в данном случае действие было гораздо более сильным.
Интересно, что даже этот, «устойчивый» к воздействию ферментов пептид разрушается в организме животного очень быстро – его концентрация уменьшается вдвое в течение нескольких минут. А вот эффект от его введения проявляется только через 5 часов и продолжается в течение еще 5 часов (рис. 3). Таким образом очевидно, что это вещество действует на клетки мозга не непосредственно, а запускает длинную цепь пока не известных событий. Конечным звеном этой цепи и является изменение баланса нейропередатчиков, приводящее к уменьшению времени бодрствования и увеличению времени обычного сна.
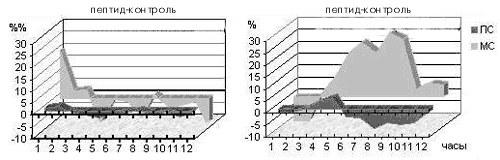
Рис. 3. Действие неактивного (слева) и активного (справа) оптических изомеров аналога дерморфина на обычный (медленноволновый, МС) и парадоксальный сон (ПС). По оси абсцисс – время от момента введения в часах. По оси ординат – разность (в %%) в продолжительности сна между опытом и контролем в среднем по группе
Открытие гипногенных (снотворных) свойств дерморфинов создает перспективы не только нового пути исследования механизмов регуляции сна, но и для создания принципиально новых лекарственных средств снотворного действия. Ведь пептиды этой группы изучены относительно неплохо – для них известны и воспринимающие рецепторы, и белки-предшественники, и гены, их кодирующие.
Кроме пептидов, чрезвычайный интерес представляет еще одна система мозга, играющая важнейшую роль в регуляции биоритмов и чередовании сна и бодрствования. Это эпифиз и выделяемый им гормон мелатонин. Эпифиз (верхний придаток мозга), являющийся «третьим глазом» у холоднокровных позвоночных и птиц, у млекопитающих утерял как способность непосредственно реагировать на свет, так и прямые нервные связи с остальным мозгом, и превратился в железу внутренней секреции. У человека эпифиз особенно активен в раннем возрасте, когда его основной функцией является, по-видимому, торможение гормонов передней доли гипофиза. В более зрелом возрасте на первый план выходит другая особенность эпифиза – его способность синтезировать мелатонин и «выбрасывать» его в строгом соответствии с внешней освещенностью, а именно в темное время суток. Информация об интенсивности окружающего освещения от сетчатки глаз поступает через зрительный нерв к супрахиазматическим ядрам преоптической области переднего гипоталамуса – «биологическим часам» организма, оттуда в «вегетативный центр» мозга, расположенный в медиальном гипоталамусе, затем через ствол и продолговатый мозг в спинной мозг и, наконец, через симпатические нервы обратно в головной мозг к пинеалоцитам – клеткам эпифиза. Интересно, что супрахиазматические ядра, в свою очередь, весьма богаты рецепторами мелатонина, т.е. обе эти структуры мозга явно взаимодействуют между собой (рис. 4).
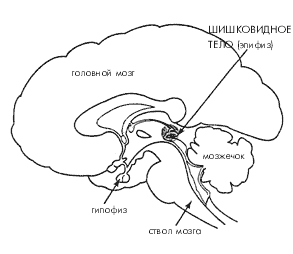
Рис. 4. Поперечный срез мозга человека (схема)
Функция эпифиза как железы внутренней секреции, выделяющей мелатонин, была установлена еще в конце 50-х годов XX века, но стала интенсивно изучаться лишь в последнее время – в связи с обширным применением синтетического мелатонина в медицине и соответствующей рекламной шумихой. Предполагается, что функция эта состоит (по крайней мере у человека) в том, чтобы обеспечить «привязку» покоя и сна к темному, а активности и бодрствования – к светлому периоду суток. И хотя исследования на людях и эксперименты на обезьянах и других млекопитающих, активных в дневное время, подтвердили прямое участие мелатонина в регуляции сна, эта гипотеза представляется все же несколько странной. Ведь синтез и выделение мелатонина происходят в темноте и блокируются на свету не только у дневных животных, но и у тех, которым свойственна ночная или сумеречная активность (рис. 5).
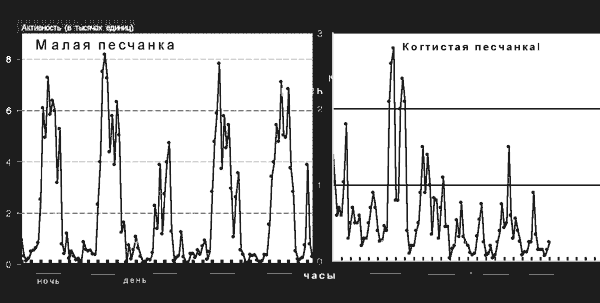
Рис. 5. Суточные ритмы активности и покоя у двух родственных видов грызунов; слева – малая песчанка, которой присуща ночная активность; справа – когтистая песчанка, активная в основном в сумерки
Экспериментами ученые провели изучение воздействия малых доз мелатонина (такие дозы обладают мягким снотворным эффектом у людей) на внутрисуточный ритм смены сна и бодрствования у подопытных кроликов, содержавшихся в условиях строгого чередования равных (12-часовых) светлых и темных периодов. Делая животным инъекцию мелатонина через час после включения света, когда уровень эндогенного («родного») гормона в их крови падает не менее чем в 15 раз по сравнению с ночным уровнем, мы ожидали обнаружить в первую очередь подавление парадоксального сна, поскольку ночью у кроликов мелатонина значительно меньше, чем днем: «много мелатонина – мало парадоксального сна», и наоборот. Однако вместо этого произошло резкое (2–3-кратное) увеличение доли парадоксального сна в течение всего 12-часового «дневного» периода (рис. 6)!
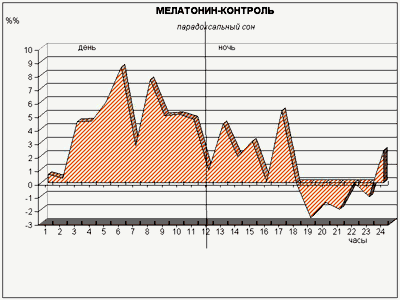
Рис. 6. Действие малой дозы мелатонина, введенной «в противофазе» с его естественной продукцией, на парадоксальный сон кроликов. Обозначения – как на рис. 3
У кроликов в лаборатории циклы сон (обычный сон, сменяемый сном пародоксальным) – бодрствование сменяют друга на протяжении примерно каждых 20 мин, вне зависимости от времени суток и освещенности. А вот соотношение обычного и пародоксального сна при этом изменяется.