Реферат: Равновесия в неводных растворах
ВЛИЯНИЕ РАСТВОРИТЕЛЯ НА РАВНОВЕСИЕ В ХИМИЧЕСКИХ СИСТЕМАХ
Проблема влияния растворителя на равновесие процессов, протекающих в химических системах, сводится в первую очередь к рассмотрению двух вопросов — как изменяется равновесие процесса при переходе из газовой фазы в данный растворитель и от; одного растворителя к другому.
Влияние физических свойств растворителя на константы равновесия процессов в химических системах может быть объяснено с электростатических позиций, если учесть, что в значительном числе случаев в первом приближении химические процессы сводятся к электростатическому взаимодействию, константа равновесия которого описывается уравнением Борна:
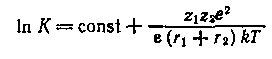
Из уравнения следует, что из физических свойств растворителя, определяющих константу равновесия, основным является диэлектрическая проницаемость. Действительно, почти во всех случаях можно установить весьма простую корреляцию между константами равновесий разнообразных процессов и диэлектрической проницаемостью.
Влияние диэлектрической проницаемости на равновесие в химических системах может быть установлено и в случае взаимодействия двух диполей.
1. Влияние растворителя на молекулярные ассоциативно-диссоциативные процессы
Во многих случаях молекулярная диссоциация ассоциированных компонентов, образующих жидкий раствор, обусловлена химическим взаимодействием между ними.
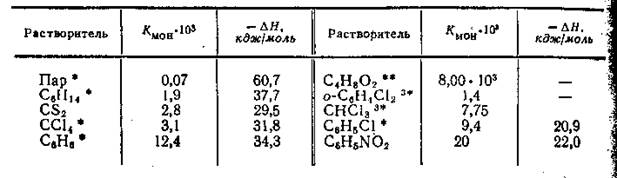
Табл.1. Константы равновесия и теплоты процесса (в кДж/моль) диссоциации димеров уксусной кислоты в различных растворителях
В табл.1 приведены значения констант равновесия про цесса распада димеров уксусной кислоты B паре и различных растворителях. Несмотря на то, что таблица составлена по данным различных авторов и данные эти относятся к довольно широкому интервалу температур, можно установить четкую корреляцию между ассоциированным состоянием уксусной кислоты и химическими свойствами растворителя. В паре молекулы уксусной кислоты практически полностью являются димерными. Во всех растворителях уксусная кислота находится в виде равновесной смеси димерных и мономерных молекул. Нетрудно заметить, что на положение равновесия диэлектрическая проницаемость оказывает гораздо меньшее влияние, чем химические свойства растворителей. Так, в растворителях, характеризующихся весьма близкими значениями ε — гексане,
сероуглероде, четыреххлористом углероде, бензоле и диоксане, величины Кмон различается весьма существенно. В химически инертных по отношению к уксусной кислоте растворителях равновесие практически смещено в сторону димера. Величина Кмон в бензоле приблизительно на порядок выше, чем в остальных инертных растворителях, что обусловлено взаимодействием (впрочем, довольно слабым) кислоты с бензолом по π-связям последнего. В диоксане же, который является растворителем с отчетливо выраженными основными свойствами, равновесие уже значительно смещено в сторону мономера.
Химические свойства растворенного вещества также в значительной степени определяют его ассоциативное состояние. Так, величины Кмон растворов уксусной, монохлоруксусной и трихлоруксусной кислот в диоксане, рассчитанные по криоскопическим данным составляют 0,8; 24 и ∞, т. е. увеличиваются по мере увеличения степени взаимодействия кислот с растворителем.
Причиной, обусловливающей распад ассоциированных молекул многих веществ, ншшстся в большинстве случаев образование Н-связи между компонентами раствора. Как известно, мерой прочности Н-связи (а, соответственно, и степени распада ассоциатов) является сдвиг максимума полосы поглощения, относящейся к группировке, которая участвует в образовании Н-связи. Спектроскопическая литература изобилует примерами, иллюстрирующими эту закономерность.
Влияние растворителя на ассоциативное состояние растворенного вещества связано прежде всего с ε. Это влияние отчетливо сказывается лишь в тех растворителях, энергией взаимодействия которых с растворенным веществом можно пренебречь по сравнению с энергией связи молекул в ассоциате. Можно установить влияние растворителя и на константу равновесия конформационных превращений молекул в растворах. Поскольку последние сопряжены с изменением дипольного момента, молекулы, следует ожидать влияния ε на константу равновесия этого процесса.
В литературе имеются весьма скудные данные по влиянию растворителя на константу равновесия процессов образования продуктов присоединения ![]() . Исследования в этом направлении охватывают ограниченный круг растворителей в небольшом интервале диэлектрических проницаемостей; кроме того, не всегда удается разграничить влияние физических и химических факторов.
. Исследования в этом направлении охватывают ограниченный круг растворителей в небольшом интервале диэлектрических проницаемостей; кроме того, не всегда удается разграничить влияние физических и химических факторов.
2. Влияние растворителя на константы устойчивости комплексных соединений
Рассмотрим вопросы, связанные с изменением константы равновесия (константы устойчивости) Кк процессов комплексообразования, т. е. процессов присоединения к иону металла иона (в частном случае нейтральной молекулы) лиганда
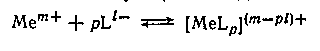
при переходе от одного растворителя к другому, либо с изменением состава смешанного растворителя.
Многочисленные литературные данные свидетельствуют, что при переходе от одного растворителя к другому состав комплексного иона может изменяться — вследствие внедрения молекул растворителя во внутреннюю сферу комплекса
![]()
или замены внедрившихся молекул одного растворителя молекулами другого
![]()
Изменение констант устойчивости комплексных, соединений с изменением растворителя (так далее будет называться переход от одного растворителя к другому, либо изменение состава двойного смешанного растворителя) обусловлено изменением как физических, так и химических характеристик среды. Кроме того, в случае комплексных соединений добавляется еще один специфический фактор, играющий большую роль в определении степени, с которой растворитель влияет на изменение Кк — это характер связи между центральным атомом и лигандом.
Для объяснения влияния физических свойств растворителя и, прежде всего, диэлектрической проницаемости на прочность комплекса в первом, а в большинстве случаев достаточно хорошем, приближении можно ограничиться представлениями о том, что взаимодействие данного типа подчиняется закономерностям электростатического взаимодействия.
Влияние сольватационной способности растворителя на величины Кк хорошо иллюстрируются примерами растворов роданидных комплексов металлов. Константы устойчивости этих комплексов в весьма близких по величинам ε растворителях (метанол, ДМФ и ацетонитрил) различаются на много порядков. Кроме того, прочность комплексов в ацетонитриле значительно выше, чем в метаноле и ДМФ — в соответствии с гораздо меньшей сольватационной способностью первого по сравнению с последними.
Иногда изменение растворителя ведет к существенному изменению природы лиганда. Так, например, глицин, который в диоксане находится в молекулярной форме, в воде находится в форме ![]() Поэтому константа устойчивости комплекса никеля с глицином в смешанном растворителе вода — диоксан изменяется чрезвычайно сильно, в то время как константы устойчивости комплексов никеля с лигандами, молекулярное состояние которых не зависит от растворителя, в этом смешанном растворителе изменяются гораздо меньше.
Поэтому константа устойчивости комплекса никеля с глицином в смешанном растворителе вода — диоксан изменяется чрезвычайно сильно, в то время как константы устойчивости комплексов никеля с лигандами, молекулярное состояние которых не зависит от растворителя, в этом смешанном растворителе изменяются гораздо меньше.
Тесная зависимость характера изменения константы устойчивости комплекса от растворителя вытекает уже из следующей элементарной предпосылки: чем выше степень ионности связи, тем влияние ε должно сказываться сильнее. В общем случае изменение устойчивости комплексов со связью Ме…..О с изменением ε более резкое, чем в комплексах со связью Me……N. Иногда уменьшение ε приводит к уменьшению устойчивости комплексов со связью Me…..N — явление, которое не свойственно в общем случае комплексам со связью Me…..О.
Так же растворитель влияет на таутомерные равновесия, константы электролитической диссоциации, силу электролитов, кислотность неводных растворов и т.д.
Список литературы: