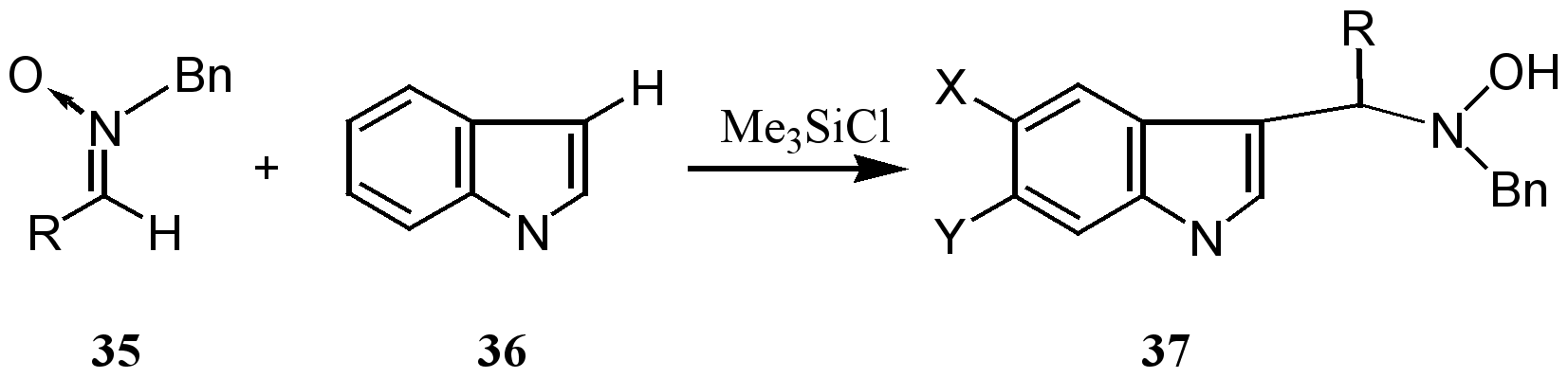Реферат: Реакции a-литиированных циклических нитронов с электрофильными реагентами
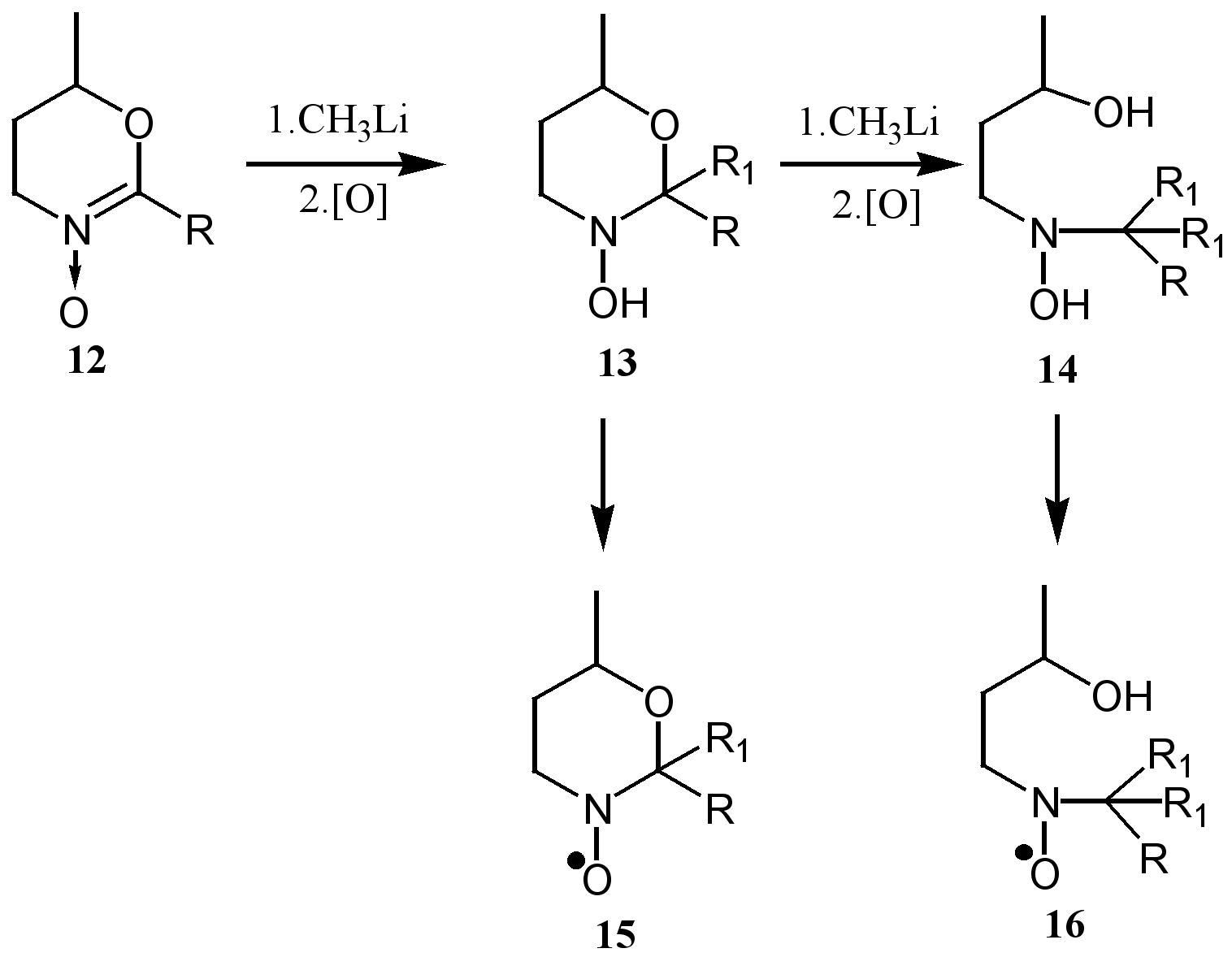
Производные тетрагидрооксазин-N-оксида 12 способны к присоединению одного или двух молей алкиллития с образованием циклического 13 или ациклического 14 производного гидроксиламина. Последующее окисление в системе Сu2+/О2 позволило авторамError: Reference source not found получить соответствующие нитроксильные радикалы 15 и 16.
В отличие от литийорганических соединений, взаимодействие 12 с метилмагнийиодидом приводит к образованию неразделимой смеси продуктов. Error: Reference source not found
1.1.3. Реакции пространственно-затруднённых нитронов с металлоорганическими реагентами.
При взаимодействии магнийорганических соединений с пространственно-затруднёнными нитронами - производными 3-имидазолин-3-оксида, наряду с образованием продуктов присоединения по атому углерода нитронной группы, возможен процесс дезоксигенирования нитронной группы.21
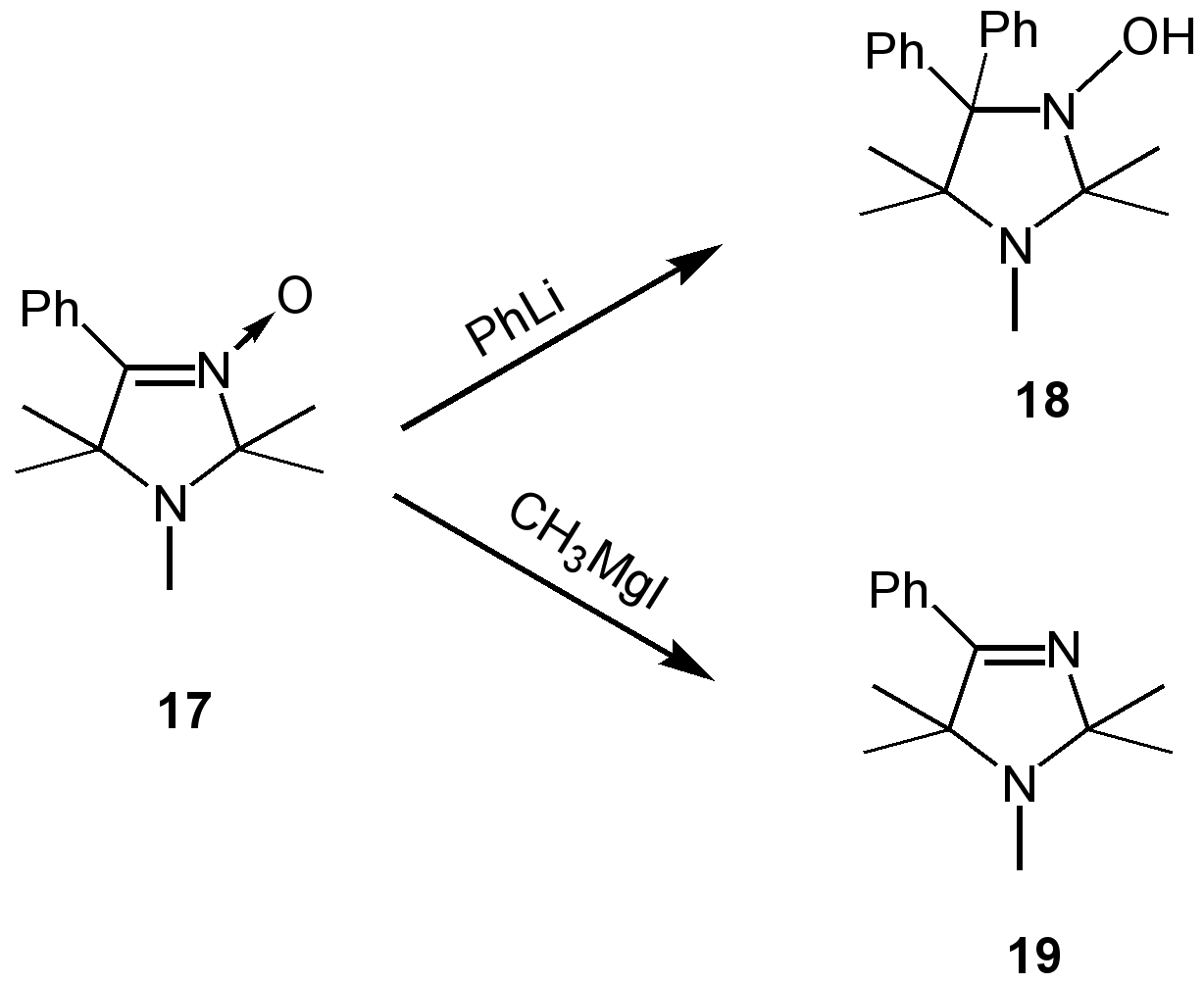
При переходе от CH3MgI к PhLi выход продукта дезоксигенирования 19 снижается с 75 до 8 %, в то время как выход продукта присоединения 18 возрастает с 7 до 60 %.
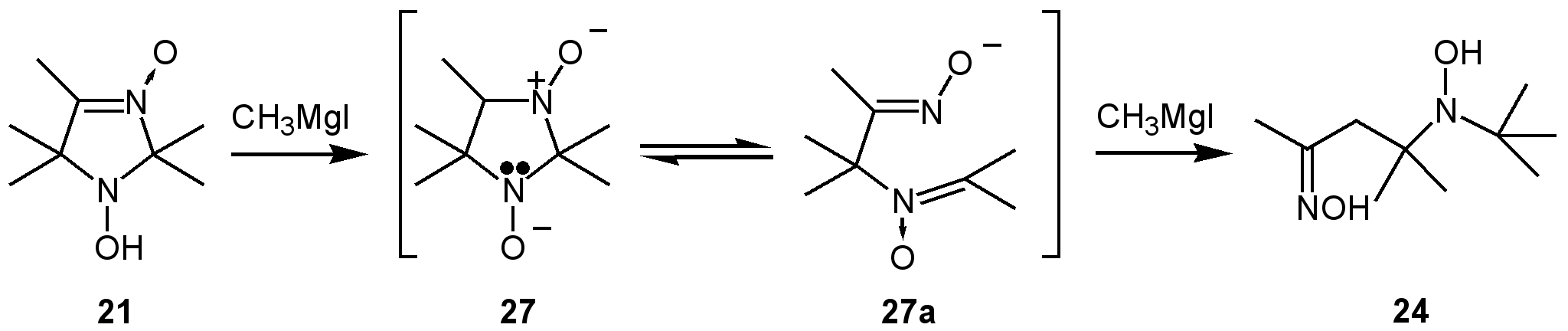
Взаимодействие магнийорганических соединений с нитроном 20 ряда 3-имидазолин-3-оксида, содержащем в составе цикла нитроксильную группу, происходит с затрагиванием радикального центра.22 При этом образуются продукты восстановления нитроксильной группы 1-гидрокси-3-имидазолин-3-оксид 21 и 1-метоксизамещённое производное 3-имидазолин-3-оксида 22.Error: Reference source not found
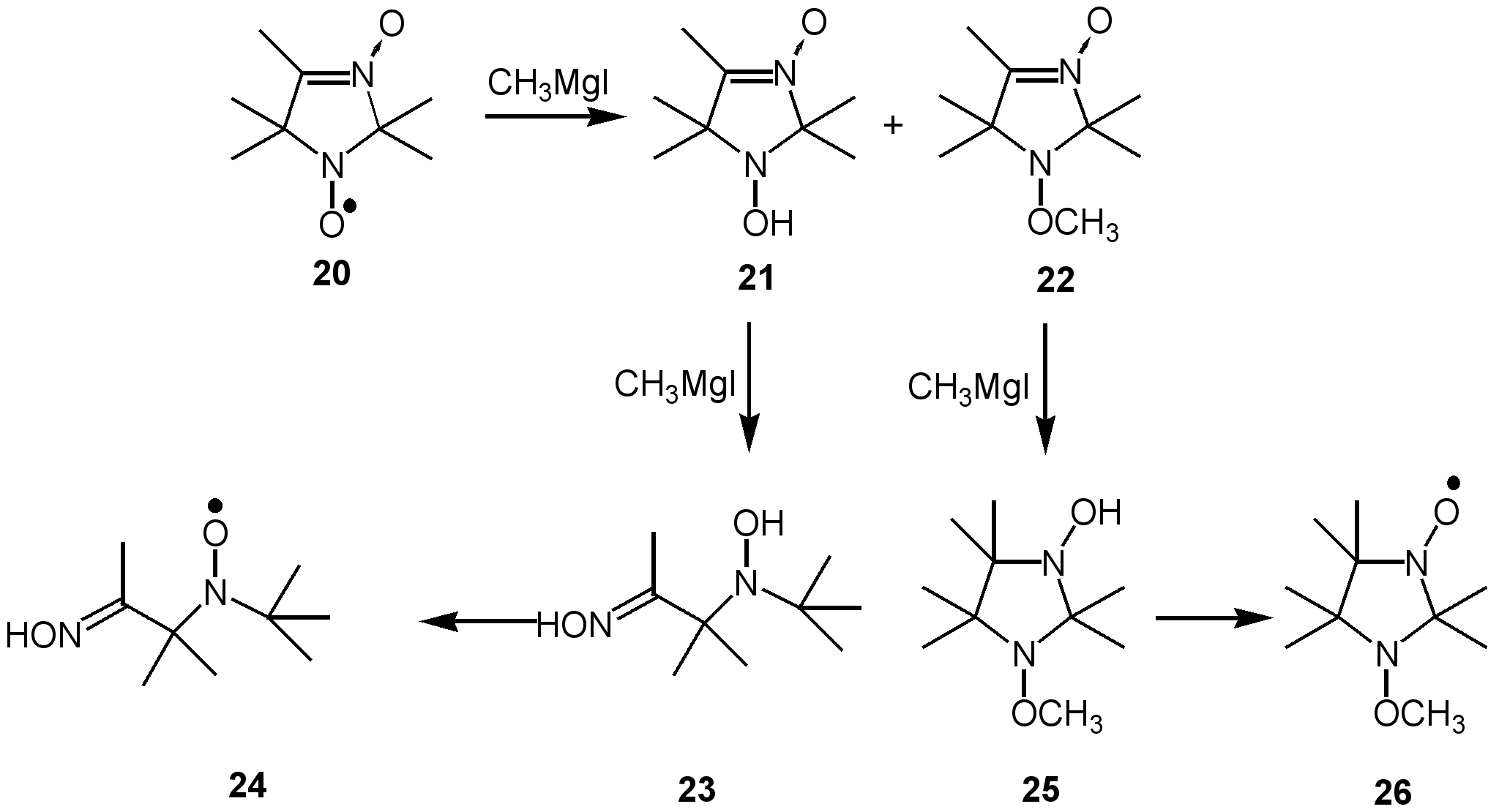
При использовании избытка реактива Гриньяра соединения 21 и 22 подвергаются дальнейшим превращениям. Метоксипроизводное 22 присоединяет реактив Гриньяра по нитронной группе с образованием 1-метокси-3-гидроксиимидазолидина 25, который легко окисляется в нитроксильный радикал 26. Соединение 21 реагирует с реактивом Гриньяра с раскрытием гетероцикла и приводит к продукту, которому была приписана структура гидроксиламинооксима 23, окисление которого избытком двуокиси свинца приводит к нитроксильному радикалу 24. Образование соединения 24 можно объяснить схемой, согласно которой при действии реактива Гриньяра на соединение 21 происходит отщепление протона от гидроксиламиногруппы с образованием аниона 27 и последующее раскрытие цикла с образованием оксиминонитрона 27a. Присоединение реактива Гриньяра по нитронной группе соединения 27a и гидролиз магниевой соли приводит к гидроксиламинооксиму 24.
1.1.4 Реакции металлоорганических соединений с нитронами, содержащими другие функциональные группы.
Если в молекуле субстрата наряду с нитронной группой имеется другая функциональная группа, способная реагировать с нуклеофильными реагентами, то строение конечного продукта будет определяться относительной скоростью нуклеофильного присоединения.
Так, в случае 2,5,5-триметил-3-оксопирролин-1-оксида 28 присоединение происходит исключительно по карбонильной группе - продуктом реакции будет только 2,5,5-триметил-3-гидрокси-3R-пирролин-1-оксид 29. В случае, когда R = t-Bu, выход составляет 92 %, а когда R = Ph - 84 %.23

При изучении реакций магнийорганических соединений с 2-цианонитроном 30 было обнаружено, что в отсутствии пространственных затруднений со стороны заместителей в третьем положении пирролинового цикла, присоединение реактива Гриньяра происходит лишь по нитронной группе. Гидролиз продукта реакции присоединения 31 происходит с отщеплением MgICN и приводит к образованию -метилнитрона 32.24

В случае 3,3,5,5-тетраметил-2-циано-пирролин-1-оксида 33, содержащего объемные гем-метильные группы в третьем положении цикла, реакция проходит лишь по нитрильной группе и приводит к образованию -кетоннитрона 34.
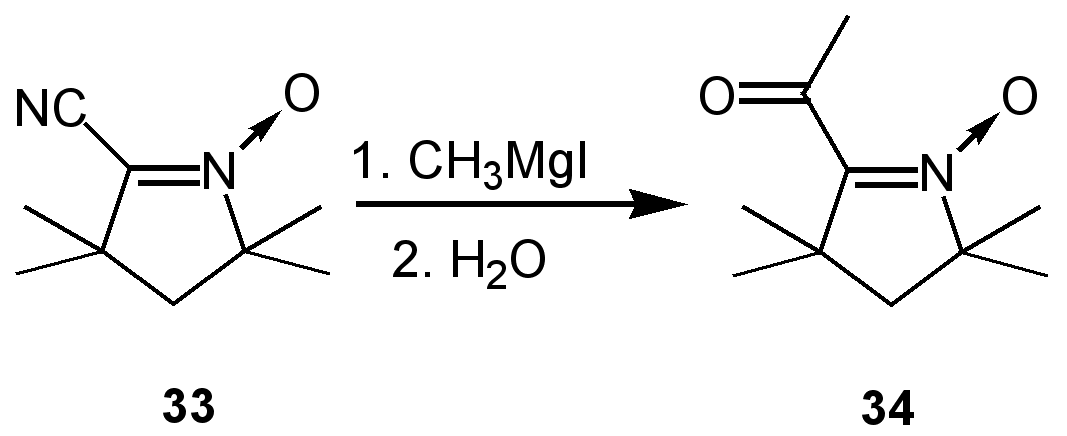
1.1.5. Реакции с анионами С-Н кислот.
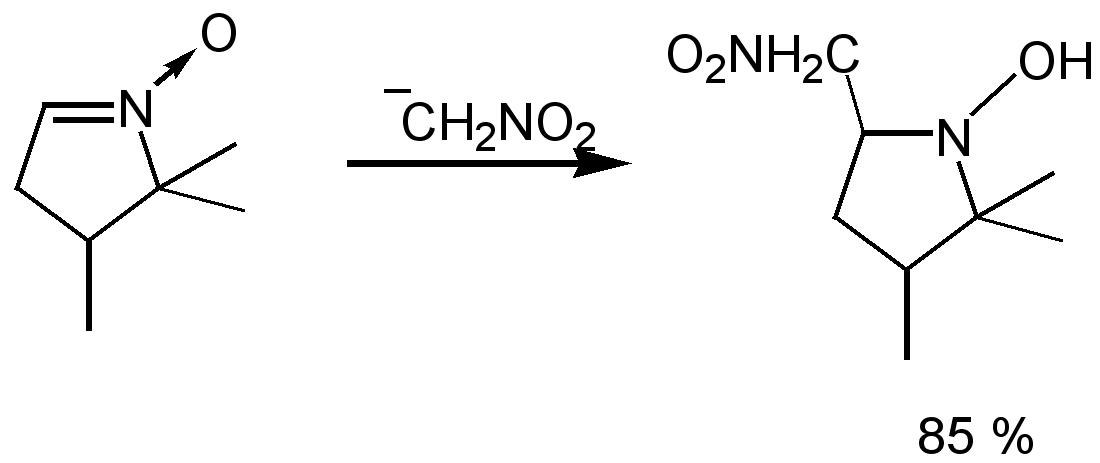
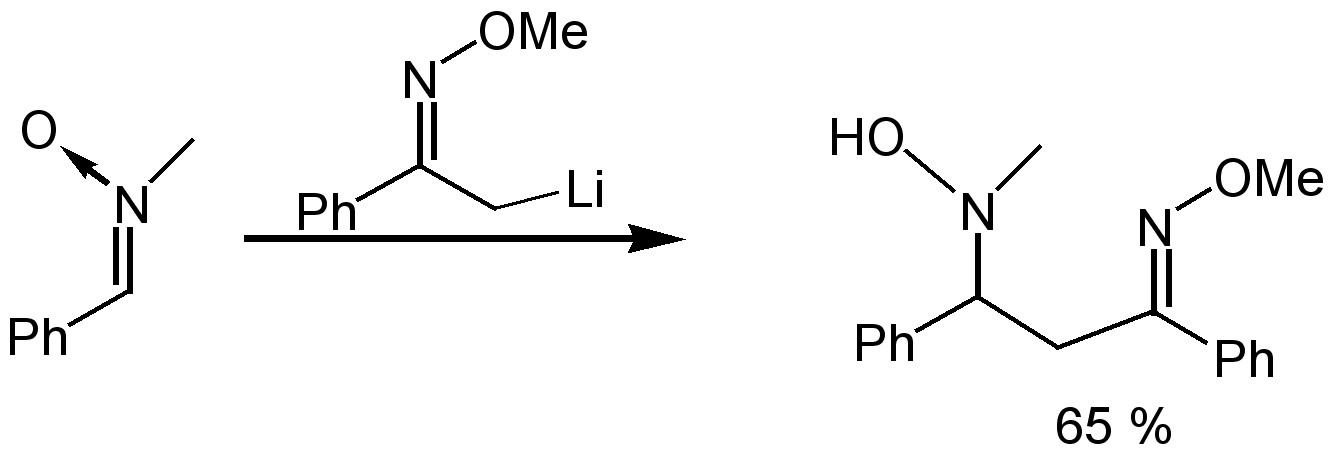
Реакции нитронов с активными СН-кислотами в присутствии оснований позволяют с высокими выходами получать продукты нуклеофильного присоединения по нитронной группе.25, 26, 27

Очень интересной и полезной с точки зрения синтеза природных соединений является реакция нитрона 38 с енолятом лития 39, генерируемым “in situ” из триметилсилиленолового эфира и метиллития, приводящая к образованию продукта нуклеофильного присоединения по нитронной группе 40. Продукт 40 претерпевает дальнейшую циклизацию с образованием изоксазолидиновой гетероциклической системы 41.28

Альдонитроны легко присоединяют цианид-анион с образованием производных гидроксиламина, которые в случае ациклических нитронов самопроизвольно дегидратируются.29 В случае пирролин-1-оксида 42 продукт присоединения 43 может быть выделен. Циангидроксиламин 43 окисляется до цианонитрона 45, который в условиях щелочного гидролиза образует смесь карбоновой 46 и гидроксамовой 47 кислот.
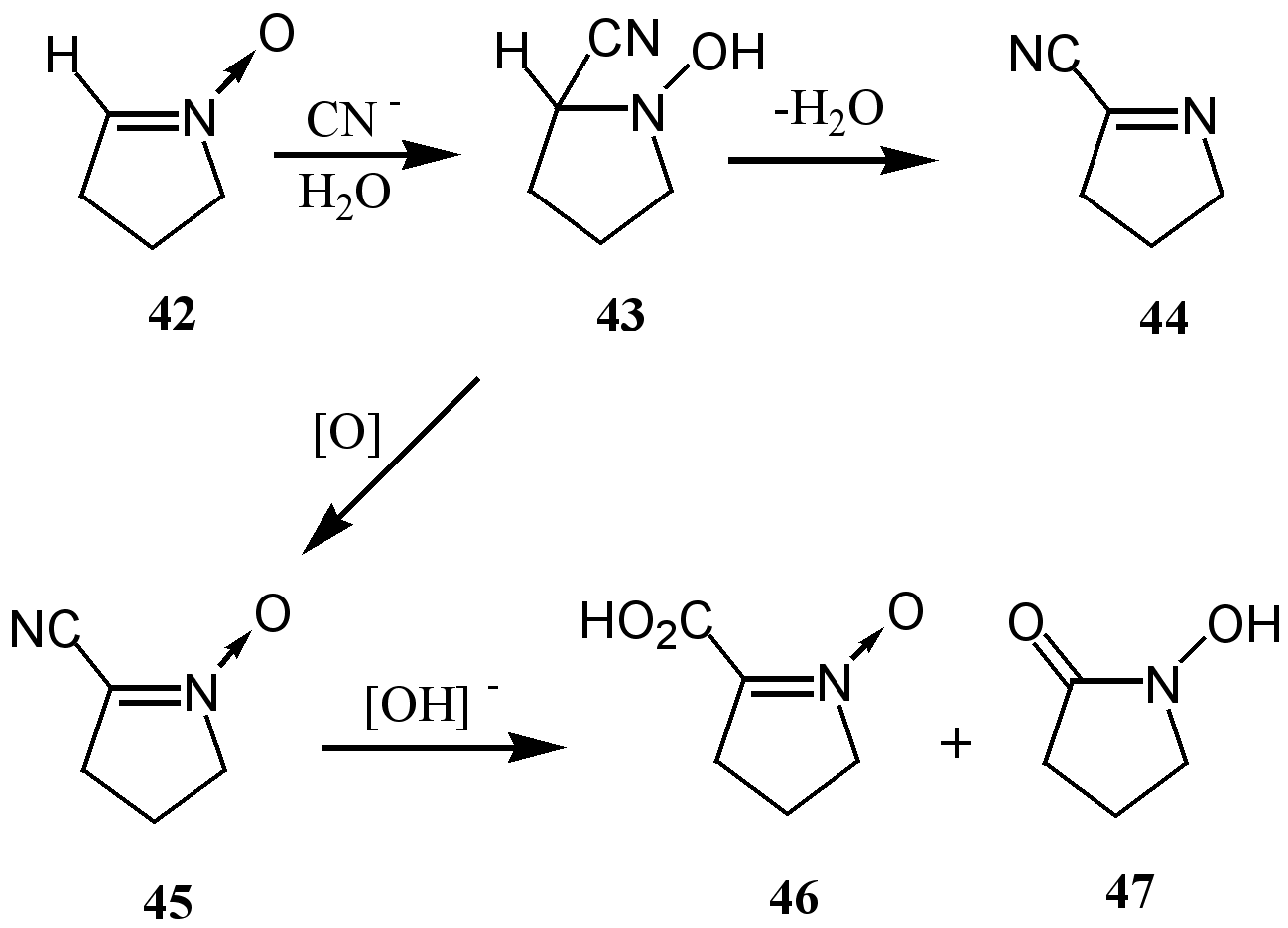
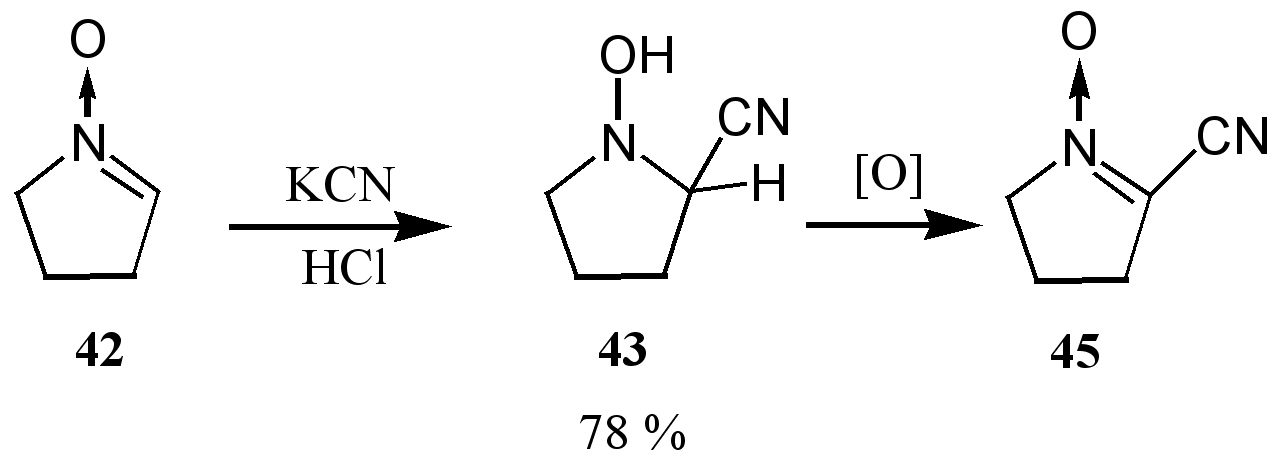
при проведении реакции в кислой среде возможно присоединение молекулы синильной кислоты.30 Продуктом реакции является гидроксиламин 43, окисление которого приводит к получению -цианонитрона 45.
Недавно был разработан метод активации нитронов, позволяющий вводить их в реакцию с такими низкореакционноспособными С-нуклеофилами, как индолы.31 Длительное кипячение в органических растворителях нитрона 35 и индола 36 не приводит к образованию продуктов присоединения по нитроннной группе. Проведении реакции в присутствии (CH3)3SiCl позволяет получить продукт реакции 37 с выходом около 80 %. Error: Reference source not found