Реферат: Реакции a-литиированных циклических нитронов с электрофильными реагентами
1.2 Присоединение нуклеофильных реагентов к хиральным нитронам
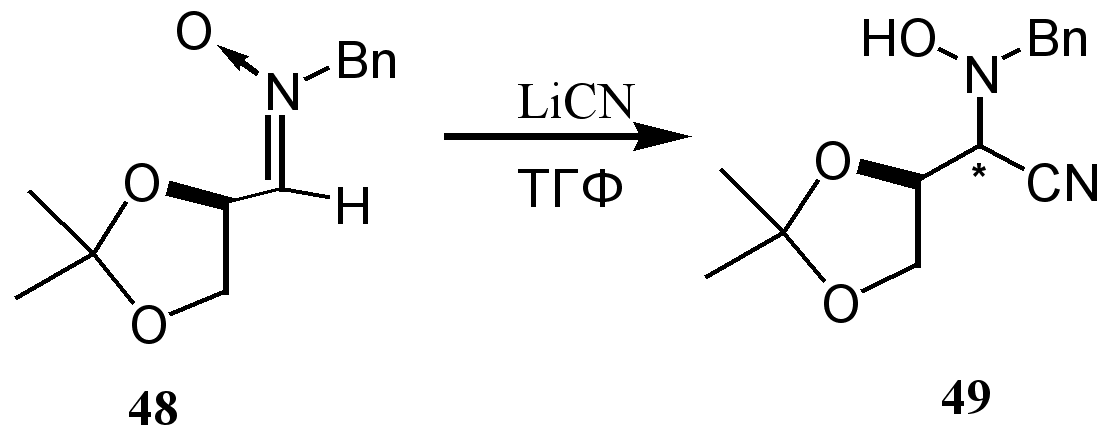
Присоединение нуклеофилов к хиральным нитронам позволяет получать оптически чистые гидроксиламины 49, которые могут быть использованы в синтезе природных соединений.32 Авторами данной работы на многочисленных примерах показано, что присоединение нуклеофильных реагентов к хиральным нитронам 48 происходит диастереоселективно.Error: Reference source not found
Соотношение продуктов син- и анти-присоединения зависит от условий реакции. Авторы показали, что в обычных условиях образуется продукт син-присоединения, но использовании кислот Льюиса (AlCl3, BF3Et2O и др.) позволяет изменить направление реакции в сторону анти- присоединения 50.

Таблица 1.
| Кислота Льюиса | Время реакции | Соотношение продуктов присоединения | |
| Анти | Син | ||
| Без к-ты | 30 мин | 95 | 5 |
|
Et2AlCl | 1 час | 4 | 96 |
1.3 Взаимодействие с элеметоорганическими соединениями.
Нуклеофильное присоединение к нитронам элементоорганических соединений приводит к образованию связи -углерод-гетероатом.
Обнаружено, что в нейтральной среде (в метаноле) происходит нуклеофильное присоединение P(OMe)3 к нитрону 51, что приводит к фосфороорганическому соединению 52, а в уксусной кислоте происходит дезоксигенирование нитрона 53 - продуктом реакции является имин 54.33


Одним из общих подходов к синтезу -алкоксинитронов является реакция окислительного алкоксилирования.34 Так, реакция 1,2,2,5,5-пентаметил-3-имидазолин-3-оксида с метанолом в присутствии PbO2 приводит к образованию -метоксинитрона 56. Однако, реакцию не всегда удаётся остановить на стадии образования -метоксинитрона, и тогда конечным продуктом реакции является нитроксильный радикал 57.

Механизм этой реакции до конца не выяснен, однако, одним из вариантов является нуклеофильное присоединение метилат-аниона к нитронной группе.35
В литературе имеется также сообщение о присоединении гидрида германия.36

Таким образом, реакции нуклеофильных реагентов с нитронами является довольно распространенным методом модификации соединений, содержащих нитронную группу. Однако, в ряде случаев, данная реакция сопровождается дальнейшими превращениями промежуточно образующихся аддуктов, что ограничивает её синтетические возможности. Кроме того, данный метод не даёт возможности широко варьировать структуру заместителей, вводимых к -атому углерода нитронной группы. Наиболее часто используемыми реагентами являются C-нуклеофилы. Использование данного подхода для образования связи -углерод-гетероатом ограничено лишь несколькими единичными случаями, что существенно ограничивает синтетический потенциал данного метода.
***
В качестве объектов исследования в данной работе были использованы следующие циклические альдонитроны: 1,2,2,5,5 пентаметил-3-имидазолин-3-оксид 58, 3,3,5,5-тетраметилпирролин-1-оксид 59, 2,2,5,5-тетраметил-3-имидазолин-3-оксид 60, 3,3-диметил-3,4-дигидроксиизохинолин-2-оксид 61 и 5,5-диметилпирролин-1-оксид 62.

2.Взаимодействие -литиированных альдонитронов с С-электрофилами.
2.1. Взаимодействие с a,b-ненасыщенными карбонильными соединениями.
Ранее было показано,Error: Reference source not found что литиирование циклических альдонитронов и последующая реакция с карбонильными соединениями приводит к продуктам присоединения по карбонильной группе. В реакцию были введены алифатические, ароматические, и гетероциклические альдегиды и кетоны.
В литературе описан единственный пример реакции -литиированного производного альдонитрона ряда 3-имидазолин-3-оксида с a,b-ненасыщенным карбонильным соединением – метилвинилкетоном.10
В данной работе нами было исследовано взаимодействие a-литиированных производных циклических альдонитронов с различными a,b-ненасыщенными карбонильными соединениями.
Так при взаимодействии литиированного производного альдонитрона 58 с окисью мезитила из реакционной смеси с выходом 92 % был выделен маслообразный продукт. В спектре ЯМР 1Н полученного соединения наряду с сигналами протонов 8 метильных групп, наблюдается характерный сигнал винильного атома водорода при 5.14 м.д. и атома водорода ОН группы при 7.85 м.д.. На основании полученных спектральных данных и данных элементного анализа полученному соединению была приписана структура 2-(1,2,2,5,5-пентаметил-3-имидазолин-3-оксид-4-ил)-бут-3-ен-2-ола 63.
.
Аналогичное взаимодействие в указанных выше условиях альдонитрона 59 - производного пирролин-1-оксида с окисью мезитила приводит к образованию 2-(2,2,4,4-тетраметилпирролин-1-оксид-2-ил)-бут-3-ен-2-ола 64 с выходом 83%.
Литиирование альдонитрона 58 s-BuLi при -70 0С и последующая обработка раствором кумарина в диэтиловом эфире приводит к образованию соединения с ярко выраженной кислотной природой: продукт реакции не удалось проэкстрагировать из водной фазы при pH » 10-11, образующейся при разложении реакционной среды водой. Подкисление реакционной среды уксусной кислотой до pH » 3 приводит к изменению цвета реакционной смеси с интенсивного малинового до жёлтого. Экстракция из подкисленного раствора и последующая отгонка растворителя позволяет получить хроматографически чистый продукт жёлтого цвета.
В ик-спектре полученного соединения, записанного в растворе СНCl3, наблюдается полоса при 3254 см-1, отнесённая к валентным колебаниям ОН группы,
а также полосы колебаний при 1576, 1597, 1612 и 1640 см-1. Поскольку эта область характерна для валентных колебаний карбонильной группы, сопряженной с кратной связью, валентных колебаний нитронной группы и С=С связей ароматического кольца, однозначное отнесение полос колебаний затруднено.