Реферат: Реакции окисления в промышленном органическом и нефтехимическом синтезе
Для расчетов промышленного реактора в случае системы PdCl2 -CuCl2 в условиях постоянной концентрации HCl по длине трубчатого реактора (труба в трубе) используют несколько измененное уравнение, найденное экспериментально на основе уравнения (6). Скорость накопления ацетальдегида (САА) или исчезновения этилена вдоль трубы длиной l описывают уравнением
![]() . (14)
. (14)
где d – внутренний диаметр трубы, м; Vсм – объем смеси этилена и раствора, поступающего в трубу, Vсм @ 0.5 м3/сек; [С2 Н4 ]l – концентрация этилена вдоль трубы в молях на м3, рассчитываемая по найденной зависимости [С2Н4]l = f (T, P)
![]() ,
,
где ![]() , rсм – плотность смеси в кг/м3;
, rсм – плотность смеси в кг/м3; ![]() , P0 – общее давление смеси, DP – понижение давления по длине трубы; l – длина трубы.
, P0 – общее давление смеси, DP – понижение давления по длине трубы; l – длина трубы.
Синтез винилацетата (реакция Моисеева). Реакция окислительной этерификации или окислительного ацетоксилирования олефинов
![]() (15)
(15)
была открыта в МИТХТ им. Ломоносова в 1960 г. Реакция осуществляется в растворах солей PdCl2 -CuCl2 и Cu(OAc)2 в уксусной кислоте в присутствии NaOAc. Температура процесса 110 – 130о С и давление 3.0 – 4.0 МПа. Селективность по этилену – 83%. Кинетическое уравнение получено Моисеевым и Беловым в системе, не содержащей CuCl2 (16)
![]() (16)
(16)
в предположении, что в условиях квадратичного торможения ацетатом натрия весь Pd(II) находится в форме комплекса Na2 Pd(OAc)4 . В работе П.Генри приведена другая форма уравнения (16) в предположении, что активной формой Pd(II) является димер Na2 Pd2 (OAc)6 , концентрация которого проходит через максимум по [NaOAc]
![]() (17)
(17)
Процесс синтеза винилацетата по реакции (15) протекает в рамках механизма, аналогичного "Вакер"-процессу. Предполагается превращение p-комплекса Pd(II) в s-палладийорганическое соединение под действием OAc– из раствора, а распад полученного интермедиата включает стадию b-элиминирования ~PdH
![]() , (18)
, (18)
где [Pd] – мономерный или димерный комплекс Pd(II). Окислением H-[Pd] и заканчивается каталитический цикл.
Фирмы Hoechst и др. разработали для реакции (15) гетерогенный катализатор, содержащий соли Pd(II), Au(III) и KOAc на Al2 O3 . Процесс протекает при 175 – 200о С и давлении 0.5 – 1.0 МПа с высокой селективностью: 94% по этилену и 98% по уксусной кислоте. Состояние Pd(II) в условиях процесса и роль соединений золота пока не ясны.
Халкон-процесс. Эпоксидирование олефинов гидропероксидами осуществляется в промышленном варианте в растворах комплексов Mo(VI). В качестве ROOH используют 2-этилфенилгидропероксид (гидропероксид этилбензола, ГПЭБ), гидропероксид кумила (ГПК) и третбутилгидропероксид (ТБГП). В случае ГПЭБ сопряженно с пропиленоксидом получают стирол:
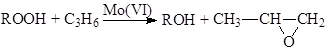 (18)
(18)
![]() (19)
(19)
Скорость реакции (18) описывается уравнением (20)
![]() (20)
(20)
где FMo = 1 + KГПЭБ[ГПЭБ] + KМФК[МФК] + KОП[ОП] + KH2O[H2O] есть закомплексованность катализатора, МФК – метилфенилкарбинол, ОП – пропиленоксид. Ki – константы равновесия образования соответствующих комплексов Mo. Как видно из уравнения (20), процесс протекает с лимитирующей стадией, переходное состояние которой включает ГПЭБ, Mo(VI) и пропилен. Показано, что активным катализатором является пропиленгликолятный комплекс Mo(VI), реакция которого с ГПЭБ и C3H6 приводит к ОП.
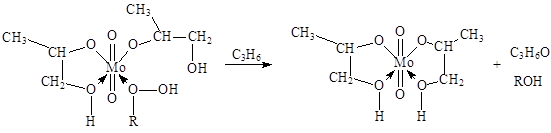
Мерокс-процесс. Реакция окислительной димеризации меркаптанов
![]() (21)
(21)
является основой процесса демеркаптанизации природного газа, попутных газов и нефтяных фракций, разработанного фирмой UOP. В водных растворах комплексов Co(II) (Pc*Co, Pc* – замещенный сульфофталоцианин) в присутствии NaOH происходит процесс образования радикалов RS·, димеризация которых дает RS-SR.
![]()
![]()
![]()
![]()