Реферат: Реакции присоединения молекул НХ с кислым атомом водорода к ненасыщенным соединениям
Реакции присоединения различных молекул НХ (Х – ОН, Cl, ОАс, CN) к ненасыщенным молекулам (олефины, диены, алкины, нитрилы, альдегиды, кетоны и др.) занимают важное место в промышленном органическом и нефтехимическом синтезе. Рассмотрим механизмы и кинетические модели некоторых процессов.
Гидратация олефинов
Реакция гидратации этилена в газовой фазе –
![]() (1)
(1)
процесс экзотермический (![]() ккал/моль), осуществляется на гетерогенных катализаторах (H3 PO4 /С, борофосфатный катализатор), которые активны лишь при Т > 300°С. При 330°С и P =1 атм равновесный выход этанола равен нулю (a@ 0). При 80 атм выход достигает ~10% (на практике лишь 5 – 6%). Если проводить процесс гидратации в жидкой фазе при температурах ниже Ткр для воды (374°С) и выше Ткр для спирта (247°С) и этилена (9,2°С), термодинамические ограничения заметно уменьшаются. Для реакции (2)
ккал/моль), осуществляется на гетерогенных катализаторах (H3 PO4 /С, борофосфатный катализатор), которые активны лишь при Т > 300°С. При 330°С и P =1 атм равновесный выход этанола равен нулю (a@ 0). При 80 атм выход достигает ~10% (на практике лишь 5 – 6%). Если проводить процесс гидратации в жидкой фазе при температурах ниже Ткр для воды (374°С) и выше Ткр для спирта (247°С) и этилена (9,2°С), термодинамические ограничения заметно уменьшаются. Для реакции (2)
![]() (2)
(2)
при Т = 330°С ![]() и
и ![]() и равновесный выход при P >135 атм достигает 48%. В этих условиях при наличии плёнки жидкой воды указанные выше катализаторы быстро теряют активность. Наилучший вариант проведения реакции (2) – атмосферное давление и температуры 80°С < Т < 100 С. В этих условиях a = 40%, однако до настоящего времени нет гомогенных или гетерогенных (в жидкой фазе) катализаторов гидратации в таких мягких условиях.
и равновесный выход при P >135 атм достигает 48%. В этих условиях при наличии плёнки жидкой воды указанные выше катализаторы быстро теряют активность. Наилучший вариант проведения реакции (2) – атмосферное давление и температуры 80°С < Т < 100 С. В этих условиях a = 40%, однако до настоящего времени нет гомогенных или гетерогенных (в жидкой фазе) катализаторов гидратации в таких мягких условиях.
По аналогии с другими процессами присоединения молекул НХ вполне очевидны возможные механизмы этой реакции в случае металлокомплексных катализаторов, например,
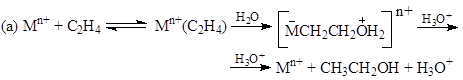
![]()

и не имеется принципиальных причин, которые бы делали невозможной реализацию этих механизмов.
Теоретический анализ сернокислотной гидратации этилена, протекающей с образованием на первой стадии процесса этилсульфата в 97% Н2 SO4 по реакции (3)
![]() (3)
(3)
показывает, что можно подобрать температуру и давление для процесса, протекающего по уравнению (2) в 50% Н2 SО4 , если скорость реакции (2) описывается уравнением (4)
![]() (4)
(4)
В этом случае увеличение константы скорости (Т), давления этилена и aH2 O должны компенсировать снижение h0 при уменьшении концентрации кислоты с 97% до 50%, процессы образования этилсульфата и его гидролиза будут протекать в одном растворе и процесс при P > 300 атм и Т = 600К становится каталитическим по Н2 SО4 .
Прямая гидратация пропилена в жидкой воде до изопропанола уже не требует столь жёстких условий. Реакция катализируется катионитом КУ-2, имеющим кислотные группы SО3 Н, при Т = 130°С и P =50 атм с выходом 10-15% спирта (равновесный выход ~ 18%).
В отличие от олефинов гидратация алкинов легко осуществляется в растворах комплексов Hg(II), Cu(I), Ru(III), Au(III) и Pd(II).
Гидратация нитрилов
Наиболее важные промышленные процессы гидратации нитрилов – реакции синтеза акриламида и адипиновой кислоты.
![]() (5)
(5)
![]() (6)
(6)
Сернокислотная гидратация нитрила акриловой кислоты (НАК) по реакции (5) осуществляется в концентрированном растворе кислоты в условиях, когда продукт гидратации – акриламид(АА) – образуется в форме сульфата акриламида
![]() (7)
(7)
Разложение соли проводят аммиаком с образованием АА и сульфата аммония (селективность по НАК ~ 80%).
Скорость стадии (7) также, как и в случае этилена определяется кислотностью среды.
![]() (8)
(8)
а механизм реакции типичен для катализа сильными кислотами:
--> ЧИТАТЬ ПОЛНОСТЬЮ <--