Реферат: ТЕРМОДИНАМИЧЕСКИЕ ФУНКЦИИ
Следовательно, в случае, когда давление остается постоянным, количество получаемой телом теплоты равно приращению энтальпии.
Дифференцирование выражения (21) с учетом (5) дает
![]() (24)
(24)
Отсюда заключаем, что энтальпия есть термодинамическая функция в переменных S и р. Её частные производные равны
![]()
![]() (25)
(25)
В соответствии с (22) теплоемкость при постоянном давлении
![]() (26)
(26)
Таким образом, если объем системы остается постоянным, то тепло Q равно приращению внутренней энергии системы. Если же постоянно давление, то оно выражается приращением энтальпии. В обоих случаях величина Q не зависит от пути перехода, а только от начального и конечного состояний системы. Поэтому на основании опытов при постоянном объеме или при постоянном давлении и могло сложиться представление о какой-то величине Q , содержащейся в теле и не зависящей от способа приведения его из нулевого состояния в рассматриваемое. Величина Q имеет различный смысл в зависимости от того, что остается постоянным: объем или давление. В первом случае под Q следует понимать внутреннюю энергию, во втором — энтальпию. Но в ранних опытах это различие ускользало от наблюдений, так как опыты производились с твердыми и жидкими телами, для которых оно незначительно благодаря малости коэффициентов теплового расширения твердых и жидких тел. В обоих случаях имеет место сохранение величины Q , но оно сводится к закону сохранения энергии.
В таблице приведены основные свойства термодинамических функций.
| Название и обозначение термодинамической функции |
Свойства | |
| Внутренняя энергия
|
|
при адиабатическом процессе |
|
|
при | |
|
Свободная энергия
|
|
при обратимом изотермическом процессе |
|
|
для равновесного состояния при | |
| Энтальпия
|
|
при |
| Термодинамический потенциал Гиббса
|
|
для равновесного состояния при |
6. Некоторые термодинамические соотношения
Итак, мы получили соотношения
![]() (27)
(27)
![]() (28)
(28)
![]() (29)
(29)
![]() (30)
(30)
Отсюда
![]()
![]() (31)
(31)
![]()
![]() (32)
(32)
![]()
![]() (33)
(33)
![]()
![]() (34)
(34)
Отметим два следствия выведенных уравнений. Из определения функций F и G следует ![]()
![]() . Подставив сюда выражения для энтропии из формул (33) и (34), получим
. Подставив сюда выражения для энтропии из формул (33) и (34), получим
![]() (35)
(35)
![]() (36)
(36)
Эти уравнения называются уравнениями Гиббса — Гельмгольца . Сразу можно отметить пользу, которую можно извлечь из этих уравнений. Часто бывает легко найти свободную энергию F с точностью до слагаемого, зависящего только от температуры. Это можно сделать, вычислив изотермическую работу, совершаемую системой. Тогда формула (35) позволяет с той же неопределенностью найти и внутреннюю энергию системы.
Если известна функция ![]() , то дифференцированием ее по S и V можно найти температуру и давление системы, т. е. получить полные сведения о ее термических свойствах. Затем по формуле
, то дифференцированием ее по S и V можно найти температуру и давление системы, т. е. получить полные сведения о ее термических свойствах. Затем по формуле ![]() можно найти
можно найти ![]() и соответствующие теплоемкости, т. е. получить полные сведения также и о калорических свойствах системы. То же самое можно сделать с помощью любого из оставшихся трех канонических уравнений состояния.
и соответствующие теплоемкости, т. е. получить полные сведения также и о калорических свойствах системы. То же самое можно сделать с помощью любого из оставшихся трех канонических уравнений состояния.
Далее, вторичным дифференцированием из соотношений (31) находим
![]()
![]()
Отсюда на основании известной теоремы анализа о перемене порядка дифференцирования следует
![]() (37)
(37)
Аналогично,
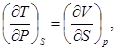 (38)
(38)
![]() (39)
(39)
![]() (40)
(40)
Эти и подобные им соотношения называются соотношениями взаимности или соотношениями Максвелла . Они постоянно используются для вывода различных соотношений между величинами, характеризующими термодинамически равновесные состояния системы. Такой метод вывода называется методом термодинамических функций или термодинамических потенциалов.