Реферат: Термодинамика
Поэтому , согласно первому началу , изменение внутренней энергии U2 -U1 системы при ее переходе под влиянием этих воздействий из первого состояния во второе равно алгебраической сумме Q и W , что для конечного процесса запишется в виде уравнения
U2 - U1 = Q - W или Q = U2 - U1 + W (1.1)
Первое начало формируется как постулат и является обобщением большого количества опытных данных .
Для элементарного процесса уравнение первого начала такого :
dQ = dU + dW (1.2)
dQ и dW не являются полным дифференциалом, так как зависят от пути следования.
Зависимость Q и W от пути видна на простейшем примере расширение газа. Работа совершенная системой при переходе ее из состояния 1 в 2 ( рис. 1) по пути а изображается площадью, ограниченной контуром А1а2ВА :
Wа = p(V,T) dV ;
а работа при переходе по пути в - площадью ограниченную контуром А1в2ВА :
Wb = p(V,T) dV.
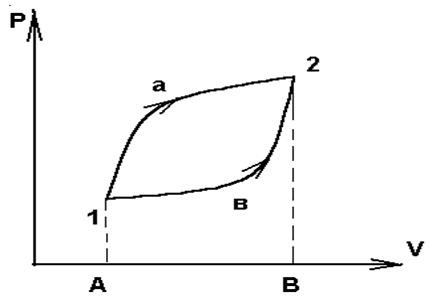
Рис. 1
Поскольку давление зависит не только от объема, но и от температуры, то при различных изменениях температуры на пути а и в при переходе одного и того же начального состояния (p1 ,V1 ) в одно и тоже конечное (p2 ,V2 ) работа получается разной. Отсюда видно , что при замкнутом процессе (цикле) 1а2в1 система совершает работу не равную нулю. На этом основана работа всех тепловых двигателей.
Из первого начала термодинамики следует, что работа может совершаться или за счет изменения внутренней энергии , или за счет сообщения системе количества теплоты . В случае если процесс круговой , начальное и конечное состояние совпадают U2 - U1 = 0 и W = Q , то есть работа при круговом процессе может совершаться только за счет получения системой теплоты от внешних тел .
Первое начало можно сформулировать в нескольких видах :
Невозможно возникновение и уничтожение энергии .
Любая форма движения способна и должна превращаться в любую другую форму движения .
Внутренняя энергия является однозначной формой состояния .
Вечный двигатель первого рода невозможен .
Бесконечно малое изменение внутренней энергии является полным дифференциалом.
Сумма количества теплоты и работы не зависит от пути процесса.
Первый закон термодинамики , постулируя закон сохранения
энергии для термодинамической системы. не указывает направление происходящих в природе процессов. Направление термодинамических процессов устанавливает второе начало термодинамики.
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ.
Второе начало термодинамики устанавливает наличие в природе фундаментальной асимметрии , т.е. однонаправленности всех происходящих в ней самопроизвольных процессов .
Второй основной постулат термодинамики связан так же с другими свойствами термодинамического равновесия как особого вида теплового движения. Опыт показывает , что если две равновесные системы А и В привести в тепловой контакт , то независимо от различия или равенства у них внешних параметров они или остаются по прежнему в состоянии термодинамического равновесия , или равновесие у них нарушается и спустя некоторое время в процессе теплообмена ( обмена энергией ) обе системы приходят в другое равновесное состояние. Кроме того , если имеются три равновесные системы А,В и С и если системы А и В поразнь находятся в равновесии с системой С, то системы А и В находятся в термодинамическом равновесии и между собой (свойства транзитивности термодинамического равновесия ).
Пусть имеются две системы . Для того , чтобы убедится в том , что они находятся в состоянии термодинамического равновесия надо измерить независимо все внутренние параметры этих систем и убедиться в том , что они постоянны во времени. Эта задача черезвычайно трудная .
Оказывается однако , что имеется такая физическая величина , которая позволяет сравнить термодинамические состояния двух систем и двух частей одной системы без подробного исследования и внутренних параметров. Эта величина , выражающая состояние внутреннего движения равновесной системы , имеющая одно и то же значение у всех частей сложной равновесной системы независимо от числа частиц в них и определяемое внешними параметрами и энергией называется температурой .
Температура является интенсивным параметром и служит мерой интенсивности теплового движения молекул.
Изложенное положение о существовании температуры как особой функции состояния равновесной системы представляет второй постулат термодинамики.
Иначе говоря , состояние термодинамического равновесия определяется совокупностью внешних параметров и температуры.