Статья: Биосинтез 2Н-меченого инозина высокого уровня дейтерированности
В настоящее время во всем мире растет интерес к получению природных биологически активных соединений (БАС), меченных стабильными изотопами (2 Н, 13 С, 15 N, 18 О и др), которые необходимы для многочисленных биохимических и диагностических целей [1], структурно-функциональных исследований [2], а также для изучения клеточного метаболизма [3]. Тенденции к предпочтительному использованию стабильных изотопов по сравнению с радиоактивными аналогами обусловлены отсутствием радиационной опасности и возможностью определения локализации метки в молекуле спектроскопией 1 Н ЯМР [4, 5], ИК- и лазерной спектроскопией [6], а также масс-спектрометрией [7]. Развитие технической и компъютерной оснащенности аналитических методов позволило существенно повысить эффективность проведения биологических исследований de novo , а также изучать структуру и механизм действия БАС на молекулярном уровне [8]. Большое научно-прикладное значение в этом аспекте имеют соединения нуклеиновой природы, содержащие дейтериевую метку в углеродном скелете молекулы [9]. В частности, 2 Н-меченые рибонуклеозиды в ближайшем будущем смогут найти применение в матричных синтезах молекул дейтерированных РНК для изучения их пространственной структуры и конформационных изменений [10].
Важным моментом в исследованиях с применением изотопно меченых БАС является их доступность. Дейтериймеченые БАС могут быть синтезированы с использованием химических, ферментативных и биосинтетических методов [11, 12]. Однако химические синтезы часто многостадийны, требуют больших расходов ценных реагентов и меченых субстратов и приводят к конечному продукту, представляющему собой рацемическую смесь D - и L -форм, для разделения которых требуются специальные методы [13]. Более тонкие синтезы меченых БАС связаны с комбинацией химических [14] и ферментативных подходов [15, 16]. Стратегия синтеза изотопно-меченых БАС более подробно освещена в работе ЛеМастера [17].
Для многих научно-практических целей биотехнология предлагает альтернативный химическому синтезу биосинтетический метод получения дейтериймеченых БАС, который приводит к высоким выходам синтезируемых продуктов, к эффективному включению дейтерия в молекулы и к сохранению природной конфигурации синтезируемых соединений [18]. Традиционным подходом при этом остается предложенный Креспи метод выращивания штаммов-продуцентов в средах с максимальными концентрациями дейтерия [19]. Однако основным препятствием является недостаток 2 Н-меченых ростовых субстратов с высоким уровнем дейтерированности. Прежде всего это связано с ограниченной доступностью и дороговизной самого высокоочищенного дейтерия, выделяемого из природных источников. Природная распространенность дейтерия составляет лишь 0.015% (относительно общего количества элемента), однако несмотря на невысокое содержание дейтерия в пробах разработанные в последние годы методы обогащения и очистки позволяют получать 2 Н-меченые субстраты высокого уровня изотопной чистоты [20].
Начиная с первых экспериментов Даболла и Кокса по выращиванию природных объектов в тяжелой воде, разрабатываются подходы с использованием гидролизатов 2 Н-меченой биомассы как ростовых субстратов для синтеза штаммов-продуцентов БАС [21, 22]. Однако эксперименты обнаружили бактериостатический эффект 2 Н2 О, заключающийся в ингибировании жизненно-важных функций клетки, оказываемой 40% 2 Н2 О на растительные клетки [23] и 80-90% 2 Н2 О на клетки простейших и бактерий [24]. Попытки использовать для синтеза в 2 Н2 О природных объектов различной таксономической принадлежности, включая бактерии, микроводоросли [25] и дрожжи [26] предпринимались в течение длительного времени. Однако широкого распространения в биотехнологии они не получили ввиду трудности синтеза, использования сложных комплексных ростовых сред, сложности технологической схемы синтеза и т. п. Поэтому целый ряд практических вопросов биосинтеза 2 Н-меченых БАС в 2 Н2 О остается не выясненным.
Более перспективны схемы синтеза с использованием в качестве 2 Н-меченых ростовых субстратов биомассы метилотрофных бактерий, ассимилирующих метанол по рибулозо-5-монофосфатному (РМФ) и сериновому пути фиксации углерода, интерес к которым возрастает благодаря интенсивному развитию технологии химического синтеза метанола [27, 28]. Уровень ассимиляции биомассы метилотрофов клетками простейших организмов и эукариот составляет 85-98%, а их производительность, измеренная по уровню биоконверсии метанола в клеточные компоненты, достигает 50% [29]. Как было показано нами раннее, метилотрофные бактерии очень неприхотливые объекты, растут на минимальных средах с 2-4% метанолом, в которых другие контаминантные бактерии не размножаются и достаточно легко адаптируются к максимальным концентрациям 2 Н2 О, что существенно для синтеза 2 Н-меченых БАС [30, 31]. Большой научно-практический интерес к использованию дейтерированной метилотрофной биомассы для синтеза продуцентов рибонуклеозидов определил цель настоящей работы, связанной с изучением принципиальной возможности биосинтеза 2 Н-меченого инозина штаммом Bacillus subtilis за счет использования гидролизата факультативных метилотрофных бактерий Brevibacterium methylicum.
Таблица 1. Изотопный состав ростовых сред и биосинтетические характеристики B. methylicum
Компоненты среды, об.% H2 O 2 H2 O Метанол [U-2 H] Метанол | Лаг-период, ч | Выход микробной биомассы, % от контроля | Время генерации, ч | ||||
| 1 | 98 | 0 | 2 | 0 | 20 | 100 | 2.2 |
| 2 | 98 | 0 | 0 | 2 | 30 | 92.3 | 2.4 |
| 3 | 73.5 | 24.5 | 2 | 0 | 32 | 90.6 | 2.4 |
| 4 | 73.5 | 24.5 | 0 | 2 | 34 | 85.9 | 2.6 |
| 5 | 49.0 | 49.0 | 2 | 0 | 40 | 70.1 | 3.0 |
| 6 | 49.0 | 49.0 | 0 | 2 | 44 | 60.5 | 3.2 |
| 7 | 24.5 | 73.5 | 2 | 0 | 45 | 56.4 | 3.5 |
| 8 | 24.5 | 73.5 | 0 | 2 | 49 | 47.2 | 3.8 |
| 9 | 0 | 98.0 | 2 | 0 | 58 | 32.9 | 4.4 |
| 10 | 0 | 98.0 | 0 | 2 | 60 | 30.1 | 4.9 |
| 10’ | 0 | 98.0 | 0 | 2 | 40 | 87.0 | 2.8 |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Для синтеза 2 Н-меченого инозина использовали мутантный штамм грамположительных бактерий Bacillus subtilis (предварительно адаптированный к дейтерию скринингом до отдельных колоний), который из-за нарушения метаболических путей регуляции биосинтеза пуриновых рибонуклеозидов синтезирует в стандартных условиях выращивания (дрожжевая среда, поздний экспоненциальный рост, 32-340 С) 17 г инозина на 1 л культуральной жидкости (КЖ) [32]. Максимальный выход инозина достигался при использовании природной протонированной среды, содержащей в качестве в качестве источников ростовых факторов и аминного азота 2% БВК дрожжей, а в качестве источника углерода и энергии глюкозу (не менее 12 мас.%). При проведении синтеза требовалось заменить протонированные ростовые субстраты их дейтерированными аналогами, а также использовать 2 Н2 О высокого уровня изотопной чистоты. Для решения поставленной задачи использовали адаптированный к дейтерию штамм факультативных метилотрофных бактерий Brevibacterium methylicum с 50% уровнем биоконверсии метанола (при эффективности конверсии 15.5-17.3 г сух. биомассы на 1 г потребленного субстрата) [33]. Проведение адаптации для B. methylicum определялось необходимостью улучшить ростовые характеристики штамма в максимально дейтерированной среде, поэтому использовали ступенчато-увеличивающийся градиент концентрации 2 Н2 О в ростовых средах в присутствии 2% метанола (табл. 1). Для изучения влияния уровня дейтерированности источника углерода на ростовые параметры штамма в опытах (1, 3, 5, 7 и 9) использовали протонированный метанол, а в опытах (2, 4, 6, 8 и 10) [U-2 Н]метанол. Согласно полученным данным замена протонированного метанола его дейтерированным аналогом в условиях одинаковой концентрации 2 Н2 О в среде приводила к небольшим уменьшениям ростовых характеристик штамма (табл. 1, опыты 2, 4, 6, 8 и 10). Поэтому в дальнейших опытах использовали среды с 2 Н2 О и [U-2 Н]метанолом. На контрольной протонированной среде (1) с водой и метанолом продолжительность лаг-периода и времени клеточной генерации B. methylicum составили 20 и 2.2 ч, а выход микробной биомассы 200 г с 1 л КЖ (табл. 1, опыт 1). В промежуточных опытах (2-10) биосинтетические параметры изменялись пропорционально концентрации 2 Н2 О. Найденная закономерность заключалась в увеличении продолжительности лаг-периода и времени клеточной генерации при уменьшении выходов микробной биомассы с фиксированием самых низких значений этих параметров в максимально дейтерированной среде с 98% 2 Н2 О и 2% [U-2 H]метанолом (табл. 1, опыт 10). За ходом адаптации, условия которой показаны в опыте 10’ (табл. 1) наблюдали, снимая динамики роста исходного (б ) и адаптированного к дейтерию (в ) штамма в максимально дейтерированной среде М9 (рис. 1, контроль (а ) получен в протонированной среде), а также по изменению продолжительности лаг-периода, времени генерации и выходов микробной биомассы (рис. 2). В отличие от адаптированного штамма (в ), ростовые динамики исходного штамма (б ) в максимальной дейтерированной среде ингибировались дейтерием (рис. 1).
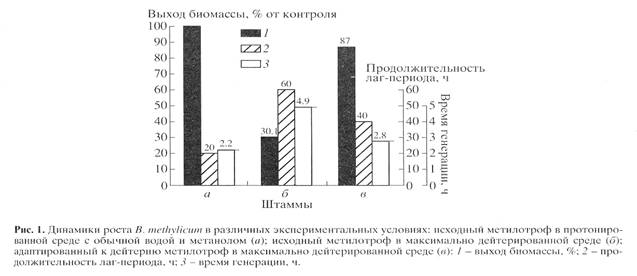
Выход микробной биомассы у адаптированного штамма (в) уменьшался на 13% по сравнению с контрольными условиями (рис. 2, а ) при увеличении времени генерации до 2.8, а продолжительности лаг-периода до 40 ч (рис. 2, в ). Адаптированный штамм возвращался к нормальному росту при переносе в протонированную среду после пролонгированного лаг-периода, что доказывает фенотипическую природу феномена адаптации, хотя теоретически не исключается, что эффект реверсии стабильно сохраняется при росте в 2 Н2 О, но маскируется при переносе клеток в протонированную среду. Улучшенные ростовые характеристики адаптированного метилотрофа существено упрощают схему синтеза 2 Н-меченой биомассы, оптимальным условиям которой удовлетворяет максимально дейтерированная среда М9 с 98% 2 Н2 О и 2% [U-2 Н]метанолом с инкубационным периодом 5-6 сут при 370 С.
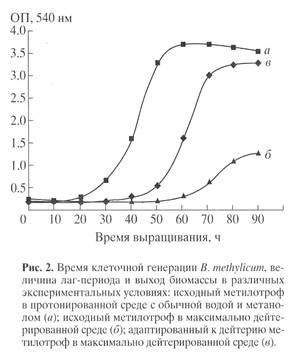
Схема синтеза 2 Н-меченого инозина разрабатывалась с учетом способности метилотрофных бактерий синтезировать большое количество белка (выход 50% от веса сухого вещества), 15-17% полисахаридов, 10-12% липидов (в основном, фосфолипиды) и 18% зольных веществ [34]. Гидролиз биомассы проводили автоклавированием в 0.5 н. 2 НCl (в 2 Н2 O), чтобы обеспечить высокие выходы этих соединений и минимизировать реакции обратного (1 Н-2 Н) обмена в аминокислотных остатках молекул белков. Качественный и количественный состав ароматических аминокислот метилотрофного гидролизата изучали в дейтерированной среде М9 на катионообменной колонке Biotronic LC-5001 (ФРГ) с сульфированной смолой UR-30, а уровни дейтерированности молекул масс-спектрометрией электронного удара метиловых эфиров N-диметиламинонафталин-5-сульфонильных производных аминокислот. Гидролизат представлен пятнадцатью идентифицированными аминокислотами (за исключением пролина, который детектировался при 440 нм) при выходах аминокислот, сопоставимом с потребностями штамма в источниках углерода и аминного азота (табл. 2). При этом индикатором, определяющим высокую эффективность включения дейтерия в синтезируемый продукт служит высокий уровень дейтерированности молекул аминокислот, который варьирует от 49% для лейцина/изолейцина до 97.5% для аланина (табл. 2).
Биосинтетические характеристики штамма B. subtilis снимали в протонированной дрожжевой среде с обычной водой и синтетической тяжеловодородной среде с 2 Н2 О и 2% 2 Н-меченым метилотрофным гидролизатом B. methylicum (рис. 3). Отмечена корреляция в характере изменения ростовых динамик (рис. 3, 1а , 2а ), выхода инозина (рис. 3, 1б, 2б ) и ассимиляции глюкозы (рис. 3, 1в , 2в ). Максимальный выход инозина (17 г/л) зафиксирован в опыте 1б (рис. 3, 1б ) на протонированной среде при уровне ассимилируемой глюкозы 10 г/л (рис. 3, 1в ). На тяжеловодородной среде выход инозина снижался в 4.4 (3.9 г/л) (рис. 3, 2б ), а уровень ассимиляции глюкозы в 4 раза, о чем свидетельствует 40 г/л неассимилируемой глюкозы в КЖ (рис. 3, 2в ).
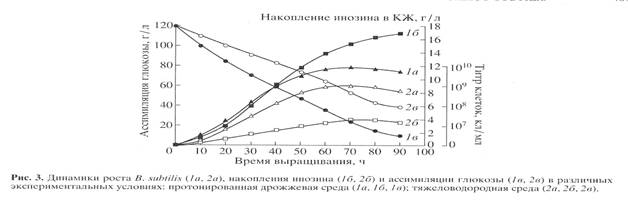
Таблица 2. Аминокислотный состав метилотрофного гидролизата и уровни дейтерированности молекул
| Аминокислота | Выход, % от сухого веса 1 г биомассы | Величина молекулярного иона Мr |
Количество включенных атомов дейтерия в углеродный скелет молекулы | Уровень дейтерированности молекул, % от общего количества атомов водорода |
| Глицин | 9.69 | 324 | 2 | 90.0 |
| Аланин | 13.98 | 340 | 4 | 97.5 |
| Валин | 3.74 | 369 | 4 | 50.0 |
| Лейцин | 7.33 | 383 | 5 | 49.0 |
| Изолейцин | 3.64 | 383 | 5 | 49.0 |
| Фенилаланин | 3.94 | 420 | 8 | 95.0 |
| Тирозин | 1.82 | 669 | 7 | 92.8 |
| Серин | 4.90 | 355 | 3 | 86.6 |
| Треонин | 5.51 | не детектировался | - | - |
| Метионин | 2.25 | не детектировался | - | - |
| Аспарагин | 9.59 | 396 | 2 | 66.6 |
| Глутаминовая кислота | 10.38 | 411 | 4 | 70.0 |
| Лизин | 3.98 | 632 | 5 | 58.9 |
| Аргинин | 5.27 | не детектировался | - | - |
| Гистидин | 3.72 | не детектировался | - | - |
Полученный результат требовал изучение содержания глюкозы в биомассе штамма после гидролиза, осуществленное методом обращенно-фазовой ВЭЖХ (табл. 3). Смесь гидролизных сахаров в табл. 3 (нумерация приведена по последовательности их элюции с колонки) составляли моно-(глюкоза, фруктоза, рамноза, арабиноза), ди-сахариды (мальтоза, сахароза), а также четыре других неидентифицированных сахара с временами удерживания 3.08 (15.63%), 4.26 (7.46%), 7.23 (11.72%) и 9.14 (7.95%) мин (не показаны). Выход глюкозы в дейтерированном гидролизате составляет 21.4% от сух. веса, то есть выше, чем фруктозы (6.82%), рамнозы (3.47%), арабинозы (3.69%) и мальтозы (11.62%). Их выхода существенно не отличались от контроля на Н2 О, за исключением сахарозы, не детектируемой в дейтерированном гидролизате.
Таблица 3. Состав сахаров гидролизата штамма-продуцента
|
протонированная среда тяжеловодородная среда | ||
| Глюкоза | 20.01 | 21.4 |
| Фруктоза | 6.12 | 6.82 |
| Рамноза | 2.91 | 3.47 |
| Арабиноза | 3.26 | 3.69 |
| Мальтоза | 15.3 | 11.62 |
| Сахароза | 8.62 | - |
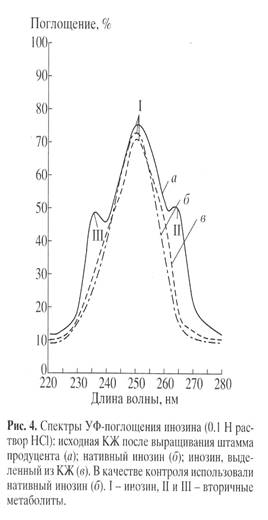
Применение сложных физико-химических методов для выделения биосинтетически 2 Н-меченого инозина из КЖ диктовалось необходимостью получать инозин высокой степени хроматографической чистоты. Поскольку в КЖ наряду с синтезируемым продуктом присутствуют примеси неорганических солей, белков и полисахаридов, а также сопутствующие вторичные метаболиты нуклеиновой природы (аденозин, гуанозин) и непрореагировавшие субстраты (глюкоза, аминокислоты), проводили ступенчатое фракционирование КЖ. Повышенная чувствительность инозина к кислотам и щелочам и его нестабильность при выделении диктовали использование кислотных и щелочных растворов низкой концентрации, а также по-возможности проводить выделение при низких температурах, избегая длительного перегрева реакционной смеси. Фракционирование КЖ заключалось в низкотемпературном осаждении высокомолекулярных примесей органическими растворителями ацетоном и метанолом, твердофазной адсорбции/десорбции на поверхности активированного угля, экстрактивного извлечения продукта, перекристаллизации и ионообменной хроматографии. Белки и полисахариды удаляли низкотемператрным осаждением ацетоном при -40 С, проводя последующую адсорбцию суммы рибонуклеозидов активированным углем на холоду. Десорбированные рибонуклеозиды извлекали из прореагировавшей твердой фазы элюцией этанольно-аммиачным раствором при 600 С, а сам инозин экстракцией 0.3 М NH4 -формиатным буфером (рН 8.9) с последующей перекристаллизацией в 80% этаноле. Окончательная стадия очистки заключалась в колоночной ионообменной хроматографии на катионообменнике AG50WX 4, уравновешенным 0.3 М NH4 -формиатным буфером с 0.045 М NH4 Cl с ТСХ контролем при Rf 0.5. Данные по выделению инозина из КЖ штамма-продуцента представлены в виде спектров УФ-поглощения на рис. 4, а-в . Наличие в синтетическом образце (в ) основной полосы поглощения I, соответствующей нативному инозину (lmax 249 нм, e249 7100 М-1 см-1 ) и отсутствие вторичных метаболитов II и III неоспоримо доказывает его однородность и тем самым эффективность разработанного метода выделения со степенью хроматографической чистоты 92%.
Уровень дейтерированности инозина исследовали методом масс-спектрометрии FAB из за высокой чувствительности, позволяющей детектировать 10-8 -10-10 моль вещества в пробе, что существенно выше чем при использовании 1 Н ЯМР-спектроскопии [7]. Пути фрагментации молекулы методом FAB приводят к распаду инозина на фрагмент рибозы А с Мr при массовом соотношении m/z 133 и гипоксантиновый фрагмент Б c Мr m/z 136 (их распад сопровождался миграцией протона Н+ ), который в свою очередь расщепляется на ряд менее низкомолекулярных осколочных фрагментов В , Г , Д , Е и Ж при m/z 109, 108, 82, 81 и 54 за счет элиминирования НСN и СО из гипоксантина (схема).
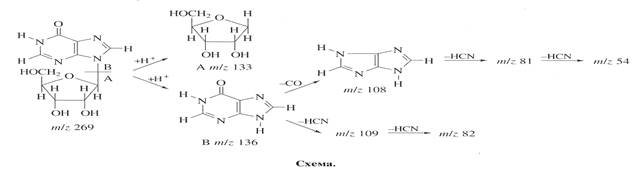
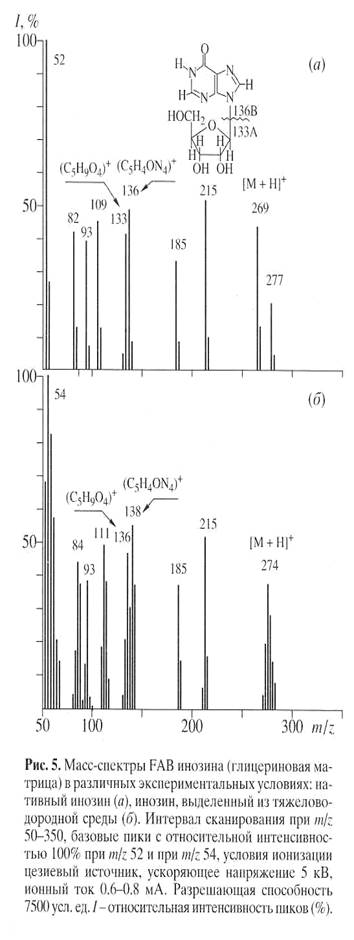
Биосинтетический 2 Н-меченый инозин (масс-спектр приведен на рис. 5, б относительно контроля (а )), представлен смесью изотопнозамещенных форм молекул с различным количеством атомов водорода, замещенных на дейтерий. Подсчет уровня дейтерированности молекулы инозина определяли, сравнивая величины пиков молекулярных ионов Мr инозина дейтерированного и протонированного образцов (формирование пика молекулярного иона инозина сопровождалось миграцией протона Н+ ). Пик (М+Н)+ полиморфно расщеплялся на отдельные кластеры с примесью молекул со статистическим набором массовых чисел m/z с различным вкладом в суммарный уровень дейтерированности с включением четырех (m/z 273, 20%), пяти (m/ z 274, 38%), шести (m/z 275, 28%) и семи атомов дейтерия (m/z 276, 14%) (табл. 4).
Суммарный уровень дейтерированности молекулы (УД), вычесленный по приводимой ниже формуле составил 61% от общего количества атомов водорода в углеродном скелете молекулы.
Mr1 C1 + Mr2 C2 + ....... +Mrn Cn
УД = ______________________________
SCn
(Mr - величины пиков молекулярных ионов инозина; Сn - вклад в уровень дейтерированности, мол.%).
Анализ масс-спектра FAB выявил включение атомов дейтерия в рибозный и гипоксантиновый фрагменты молекулы, что подтверждено присутствием двух “тяжелых” пиков фрагментов рибозы А m/z 136, 46% (вместо m/z 133, 41%) и гипоксантина Б m/z 138, 55% (вместо m/z 136, 48%), а также пиков низкомолекулярных фрагментов, продуктов распада гипоксантина В m/z 111, 49% (вместо m/z 109, 45%) и Г m/z 84, 43% (вместо m/z 82, 41%) (рис. 5).
Таблица 4. Величины пиков (М+Н)+ в масс-спектрах FAB и уровни дейтерированности инозина
|
Величина пика (М+Н)+ | Вклад в уровень дейтерированности, мол.% | Количество атомов дейтерия | Уровень дейтерированности, % от общего количества атомов водорода |
| 273 | 20 | 4 | 20.0 |
| 274 | 38 | 5 | 62.5 |
| 275 | 28 | 6 | 72.5 |
| 276 | 14 | 7 | 87.5 |
Эффект множественного мечения определяется способом получения дейтерированных молекул и свидетельствует о недостаточно высокой селективности биосинтетической схемы, повысить которую возможно контролем изотопного состава синтетической ростовой среды и исключения источников дополнительных протонов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
--> ЧИТАТЬ ПОЛНОСТЬЮ <--