Статья: Исследование процесса физиологической адаптации бактерий к тяжёлой воде
Н2 О 2 H2 О метанол [U-2 Н]метанол часы % от конт- часы
роля
Для проведения адаптации был выбран ступенчатый режим увеличения концентрации 2 H2 О в ростовых средах в присутствии 0.5-1% метанола/[U-2 H]метанола , так как мы предположили, что постепенное привыкание организма к дейтерию будет оказывать благоприятный эффект на параметры роста и общее самочувствие культуры (табл. 1). При этом штамм M. flagellatum обнаружил повышенную чувствительность к 2 H2 O: ингибирование скорости роста бактерий наблюдалось при концентрации 2 H2 О в среде 74.5%, в то время как [U-2 H]метанол не оказывал существенного влияния на скорость роста культуры. Так, на среде, содержащей 74.5% 2 H2 О выход микробной биомассы составил 29%, что в 3.4 раза ниже, чем в контрольных экспериментах, когда использовали обычную воду и метанол(табл. 1, опыт 1), в то время как выход микробной биомассы на водной среде с 1% [U-2 H]метанолом был снижен всего лишь в 1.2 раза. В связи с тем, что роста бактерий на более высокой концентрации 2 H2 O достичь не удалось в дальнейших экспериментах использовали биомассу M. flagellatum, полученную со среды, содержащей 74.5% 2 H2 О.
Адаптация факультативных метилотрофных бактерий B. methylicum .
Попытки адаптировать штамм B. methylicum к росту на максимально дейтерированной среде при сохранении способности к биосинтезу фенилаланина привели к положительному результату. К данному штамму метилотрофных бактерий был применён специальный подход по адаптации, который заключался в серии из нескольких адаптационных пассажей исходной культуры на твёрдых агаризованных средах с 2% [U-2 H]метанолом при ступенчатом увеличении концентрации тяжёлой воды в них (от 0 до 98% 2 H2 О), как показано в табл. 2. При этом последовательно отбирали отдельные колонии, выросшие на средах, содержащих дейтерий. Затем их пересевали на среды с большей степенью дейтерированности, включая среду с 98% 2 H2 О (степень выживаемости бактерий на конечной максимально дейтерированной среде составила не более 50%). За ходом адаптации следили по изменениям продолжительности лаг-фазы, времени клеточной генерации и выходов микробной биомассы, а также по максимальному уровню накопления фенилаланина в культуральной жидкости (рис. 1).
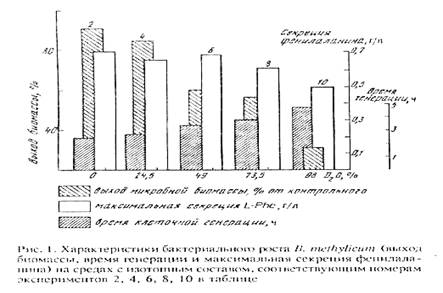
В отсутствии дейтериймеченных субстратов продолжительность лаг-фазы не превышала 20 ч, в то время как с увеличением концентрации 2 H2 О в ростовых средах до 98% продолжительность лаг-фазы увеличивалась до 60 часов (таблица 2, опыт 10). Отмечено, что длительность времени клеточной генерации с увеличением концентрации 2 H2 O в ростовых средах постепенно увеличивается, достигая 4,9 часов на среде с 98% 2 H2 O и 2% [U-2 H]метанолом (табл. 2, опыт 10). В отличие от тяжёлой воды, [U-2 H]метанол не вызывал существенного ингибирования роста и не оказывал влияния на выходе микробной биомассы. Напротив, на максимально дейтерированнной среде выход микробной биомассы был снижен в 3.3 раза по сравнению с контролем. Важно то, что выход микробной биомассы и уровень накопления фенилаланина в культуральной жидкости при росте адаптированного к 2 Н2 О микроорганизма в максимально дейтерированной среде изменяются по сравнению с контрольными условиями на 13 и 5%, т. е. незначительно (табл. 2, опыт 10’).
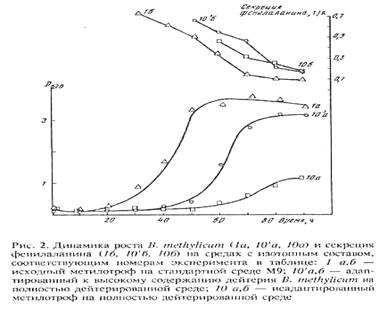
Адаптированные к 2 Н2 О клетки сохранили способность синтезировать и экзогенно продуцировать фенилаланин в ростовую среду. Причём общей особенностью биосинтеза фенилаланина в Н2 О/2 H2 O-средах было увеличение его продукции на раней фазе экспоненциального роста B. methylicum , когда выход микробной биомассы был незначителен (рис. 2). Во всех экспериментах наблюдалось ингибирование биосинтеза фенилаланина на поздней фазе экспоненциального роста и снижение его концентрации в ростовых средах. Согласно данным по микроскопическому исследованию растущей популяции микроорганизмов, подобный характер динамики секреции фенилаланина не коррелировал с качественными изменениями ростовых характеристик культуры на различных стадиях роста, что служило подтверждением морфологической однородности микробной популяции. Скорее всего, накопленный в процессе роста фенилаланин ингибировал ферменты собственного пути биосинтеза. Кроме того, не исключена возможность, что при ферментации без рН-статирования может происходить как обратное превращение секретируемого фенилаланина в интермедиаторные соединения его биосинтеза, так и ассимиляция фенилаланина клеткой для обеспечения собственных метаболических потребностей, что отмечено в других работах [27, 28]. Данные по исследованию культуральной жидкости методом ТСХ показали, что кроме фенилаланина штамм B. methylicum синтезирует и накапливает в культуральной жидкости (на уровне 5-6 ммоль) другие аминокислоты (аланин, валин, лейцин, изолейцин), присутствие которых также подтверждалось масс-спектрометрическим анализом метиловых эфиров их DNS-производных.
Табл. 2
Влияние изотопного состава среды на рост штамма B. methylicum и уровень накопления фенилаланина в культуральной жидкости (КЖ)
|
Номер Компоненты среды, % Величина Выход Время ген. Уровень опыта лаг-фазы биомассы накопле- Н2 О 2 H2 О метанол [U-2 Н]метанол часы % от кон- ния Phe троля в КЖ % от контроля | ||||||||
| 1 | 98 | 0 | 2 | 0 | 20 | 100 | 2.2 | 100 |
| 2 | 98 | 0 | 0 | 2 | 30 | 92.3 | 2.4 | 99.1 |
| 3 | 73.5 | 24.5 | 2 | 0 | 32 | 90.6 | 2.4 | 96.3 |
| 4 | 73.5 | 24.5 | 0 | 2 | 34 | 85.9 | 2.6 | 97.1 |
| 5 | 49.0 | 49,0 | 2 | 0 | 40 | 70.1 | 3.0 | 98.0 |
| 6 | 49.0 | 49.0 | 0 | 2 | 44 | 60.5 | 3.2 | 98.8 |
| 7 | 24.5 | 73.5 | 2 | 0 | 45 | 56.4 | 3.5 | 90.4 |
| 8 | 24.5 | 73.5 | 0 | 2 | 49 | 47.2 | 3.8 | 87.6 |
| 9 | 0 | 98.0 | 2 | 0 | 58 | 32.9 | 4.4 | 42.5 |
| 10 | 0 | 98.0 | 0 | 2 | 60 | 30.1 | 4.9 | 37.0 |
| 10’ | 0 | 98.0 | 0 | 2 | 40 | 87.0 | 2.9 | 95.0 |
Так как данный штамм метилотрофных бактерий удалось адаптировать к 2 Н2 О, исследование принципиальной возможности использования гидролизатов его биомассы для культивирования других штаммов продуцентов представлялось весьма актуальным. Следует подчеркнуть, что усваиваемость биомассы метилотрофов клетками эукариот составляет 85-99%, а производительность метилотрофов, измеренная по уровню конверсии метилового спирта достигает 50% [29]. При этом учитывалось, что метилотрофные бактерии при росте на метаноле способны синтезировать большое количество полноценных белков (до 55% от веса сухого вещества) [30], а также некоторое количество полисахаридов (до 10%) [31], причем эта способность сохраняется при росте на средах, содержащих 2 Н2 О и [U-2 H]метанол. Для выделения этих соединений из (2 Н)меченой биомассы метилотрофных бактерий было необходимо проводить её гидролиз. Для этого использовали два метода гидролиза биомассы - щадящий гидролиз путём автоклавирования в 0.5 н. растворе 2 HCl (в 2 H2 O) (30 мин, 08 ати) и исчерпывающий гидролиз биомассы в 6 н. 2 HCl (в 2 H2 O) (24 часа, 110 0 С). В предварительных экспериментах было показано, что по-первому варианту гидролиза биомассы реализуется гораздо большая питательность суспензии метилотрофных бактерий по сравнению с гидролизом в 6 н. 2 HСl. Поэтому мы отдали предпочтение этому методу проведения гидролиза биомассы.
Табл. 3
Качественный и количественный состав аминокислот, выделенных из белковых гидролизатов B. methylicum
|
протонированный гидролизат гидролизат, полученный 98% 2 H2 О и 2% [U-2 Н ]метанола | ||
| Глицин | 8.03 | 9.69 |
| Аланин | 12.95 | 13.98 |
| Валин | 3.54 | 3.74 |
| Лейцин | 8.62 | 7.33 |
| Изолейцин | 4.14 | 3.64 |
| Фенилаланин | 3.88 | 3.94 |
| Тирозин | 1.56 | 1.82 |
| Аспарагиновая кислота | 7.88 | 9.59 |
| Глутаминовая кислота | 11.68 | 10.38 |
| Лизин | 4.37 | 3.98 |
| Гистидин | 3.43 | 3.72 |
| Треонин | 4.81 | 5.51 |
| Метионин | 4.94 | 2.25 |
| Аргинин | 4.67 | 5.27 |
Вследствие того, что используемые в работе бактериальные штаммы были представлены их ауксотрофными по определенным аминокислотам формами, было необходимо оценить сколько данных аминокислот содержится в гидролизатах биомассы и каковы уровни их дейтерированности. В гидролизате биомассы, полученной с 2 H2 O-среды было зафиксировано небольшое снижение содержания лейцина, изолейцина, глутаминовой кислоты, лизина и метионина по сравнению с биомассой, полученной на обычной воде (табл. 3). Содержания аланина, аспарагиновой кислоты, треонина и аргинина в дейтерированном белке, напротив, немного превышают контрольные показатели, снятые в Н2 О. Таким образом, достигнутый результат в опытах по адаптации B. methylicum к 2 H2 О, позволил использовать гидролизаты его (2 Н)меченой биомассы, полученной в ходе многоступенчатой адаптации к 2 H2 О в качестве ростовых субстратов для выращивания бацилл Bacillus subtilis , а также штамма галофильных бактерий Halobacterium halobium. При этом, показателем, позволяющим надеяться на высокую эффективность включения дейтерия в продукты, синтезируемыми данными бактериальными штаммами, служит высокий уровень дейтерированности аминокислот суммарного белка этих бактерий, измеренный на метиловых эфирах DNS-производных аминокислот, за исключением лейцина и метаболически родственных с ним аминокислот, сниженные уровни дейтерированности которых объясняются эффектом ауксотрофности данного метилотрофного штамма влейцине (табл. 4).
Табл. 4
Уровни дейтерированности аминокислот суммарных белков B. methylicum , полученных в ходе многоступенчатой адаптации к 2 H2 O
| Метиловые эфиры дансилпроизводных аминокислот | Величина молекулярного иона (М+ ) | Количество включенных атомов дейтерия | Уровень дейтерированности аминокислот, % |
| Dns-Gly-OMe | 324.0 | 1.8 | 90.0 |
| Dns-Ala-OMe | 340.3 | 3.9 | 97.5 |
| Dns-Val-OMe | 368.5 | 4.0 | 50.0 |
|
Dns-Leu-OMe (Dns-Ile-OMe) | 383.4 | 4.9 | 49.0 |
| Dns-Phe-OMe | 419.6 | 7.6 | 95.0 |
| Dns-Tyr-OMe | 668.5 | 6.5 | 92.8 |
| Dns-Ser-OMe | 354.8 | 2.6 | 86.6 |
| Dns-Thr-OMe | - | - | не определяли |
| Dns-Met-OMe | - | - | не определяли |
| Dns-Asp-OMe | 396.4 | 2.0 | 66.6 |
| Dns-Glu-OMe | 411.0 | 3.5 | 70.0 |
| Dns-Lys-OMe | 632.4 | 5.3 | 58.9 |
| Dns-Arg-OMe | - | - | не определяли |
| Dns-Нs-OMe | - | - | не определяли |
Адаптация бацилл B. subtilis .
В следующих опытах была исследована способность к росту на 2 H2 О бациллярного штамма B. subtilis , продуцента инозина. Рост данного штамма лучше всего происходил на ГС 1 среде, содержащей в качестве источника углерода глюкозу, а в качестве источника ростовых факторов гидролизаты (2 Н)меченой биомассы метилотрофных бактерий B. methylicum .
Данный штамм удалось адаптировать к дейтерию путём рассева на твёрдую агаризованную среду ГС 1 со 100% 2 H2 О. Он сразу обнаружил нормальный рост в присутствии 2 Н2 О. При культивировании адаптированного B. subtilis на жидкой ГС 1 среде, уровень накопления инозина в культуральной жидкости снижается по-сравнению с исходным штаммом. Например, при росте исходного штамма B. subtilis на среде, содержащей обычную воду и протонированную биомассу уровень накопления инозина в культуральной жидкости достигал величины 17 г/л после пяти суток культивирования (рис. 3). Вместе с тем уровень накопления инозина на ГС 1 среде, был снижен в 4.4 раза по сравнению с исходным штаммом на протонированной среде. Сниженный уровень продукции инозина на в этих условиях коррелирует со степенью конверсии глюкозы, которая на 2 H2 O ассимилировалась не полностью, о чём свидетельствовали значительные количества накопленной в культуральной жидкости глюкозы после ферментации. Поэтому было интересно оценить содержание глюкозы в гидролизатах биомассы B. subtilis. В состав гидролизатов внутриклеточных сахаров данного штамма входят глюкоза, фруктоза, рамноза, арабиноза, мальтоза и сахароза (табл. 5). Важно, что содержание глюкозы в дейтерированной биомассе достигает 21.4%, т. е. значительно выше, чем для других сахаров. Содержания других сахаров в анализируемых образцах существенно не отличаются от таковых для Н2 О, за исключением сахарозы, которая в дейтерированном образце не детектируется (табл. 5).
Табл. 5
Качественный и количественный состав сахаров, выделенных из гидролизатов биомассы B. subtilis .
|
протонированный гидролизат гидролизат, полученный со 100% 2 H2 О | ||
| Глюкоза | 20.01 | 21.40 |
| Фруктоза | 6.12 | 6.82 |
| Рамноза | 2.91 | 3.47 |
| Арабиноза | 3.26 | 3.69 |
| Мальтоза | 15.30 | 11.62 |
| Сахароза | 8.62 | - |
Адаптация галофильных бактерий H. halobium .
В случае с H. halobium адаптацию проводили как на агаре, содержащим 100% 2 H2 О с добавлением гидролизатов (2 Н)меченой биомассы B. methylicum, путём рассева штамма до отдельных колоний, так и на жидкой ГС 2 среде. В обычных для этой культуры условиях культивирования (37 0 С, на свету) в клетках синтезировался фиолетовый пигмент по всем характеристикам не отличающийся от нативного бактериородопсина.
Проведённые исследования подтвердили, что способность к адаптации к 2 Н2 O у разных родов и видов бактерий различная и может варьировать на примере метилотрофных бактерий в пределах даже одной таксономической группы. Из этого можно заключить, что адаптация к 2 H2 О определяется как таксономической специфичностью микрооорганизмов, так и особенностями их метаболизма, функционированием различных путей ассимиляции субстратов, а также эволюционной нисшей, которую занимает исследуемый объект. При этом чем ниже уровень эволюционного развития организма, тем лучше он приспосабливается к присутствию дейтерия в среде. Так, из изученных объектов самыми примитивными в эволюционном плане являются галофильные бактерии, относящиеся к археобактериям, практически не нуждающие в адаптации к 2 Н2 О, чего нельзя сказать о метилотрофных бактериях, которые труднее адаптируются к 2 Н2 О. Для всех изученных микроорганизмов рост на высокодейтерированных средах сопровождался снижением ростовых характеристик а также уровня продукции секретируемых БАС. Полученные для изученных микроорганизмов данные в целом подтверждают устойчивое представление о том, что адаптация к 2 H2 О является фенотипическим явлением, поскольку адаптированные к тяжелой воде клетки возвращаются к нормальному росту и биосинтезу в протонированных средах после некоторого лаг-периода. По-видимому, метаболизм адаптированных клеток не претерпевает существенных изменений в 2 H2 O. В то же время эффект обратимости роста на 2 H2 O/Н2 O- средах теоретически не исключает возможности того, что этот признак стабильно сохраняется при росте в Н2 О, но маскируется при переносе клеток на дейтерированную среду. Однако, здесь необходимо подчеркнуть, что для проведения адаптации играет немаловажную роль состав среды культивирования. При этом не исключено, что при проведении адаптации на минимальных средах, содержащих 2 Н2 О образуются формы бактерий, ауксотрофные по определенным ростовым факторам, например аминокислотам, и вследствие этого бактериальный рост ингибируется. В то же время адаптация к 2 Н2 О происходит лучше всего именно на комплексных средах, содержащих широкий набор ростовых факторов и аминокислот, компенсирующих потребность бактерий в этих соединениях. Можно также предположить, что клетка реализует лабильные адаптивные механизмы, которые способствуют функциональной реорганизации работы жизненно-важных систем в 2 H2 O. Так, например, нормальному биосинтезу и функционированию в 2 H2 О таких биологически активных соединений, как нуклеиновые кислоты и белки способствует поддержание их структуры посредством формирования водородных (дейтериевых) связей в молекулах. Связи, сформированные атомами дейтерия различаются по прочности и энергии от аналогичных водородных связей [32]. Различия в нуклеарной массе атома водорода и дейтерия косвенно могут служить причиной различий в синтезах нуклеиновых кислот, которые могут приводить в свою очередь к структурным различиям и, следовательно, к функциональным изменениям в клетке. Вероятнее всего, что ферментативные функции и структура синтезируемых белков также изменяются при росте клеток на 2 H2 О, что может отразиться на процессах метаболизма и деления клетки. Некоторые исследователи сообщают, что после обратного изотопного (1 Н-2 H)-обмена ферменты не прекращают своей функции, но изменения в результате изотопного замещения за счет первичного и вторичного изотопных эффектов, а также действие 2 H2 О как растворителя (большая структурированность и вязкость по сравнению с Н2 О) приводили к изменению скоростей и специфичности ферментативных реакций в 2 H2 O [33].
Структурно-динамические свойства клеточной мембраны, которые в большинстве зависят от качественного и количественного состава липидов, также могут изменяться в присутствии 2 H2 O. Так, сравнительный анализ липидного состава дейтерированных клеток B. subtilis , полученных при росте на 2 H2 O показал различия в количественном составе мембранных липидов по сравнению с Н2 О (рис. 4). Примечательно, что в дейтерированном образце соединения, имеющие времена удерживания - 33.38; 33.74 и 33.2 мин не детектируются (рис. 4 б). Полученный результат, по видимому, объясняется тем, что клеточная мембрана является одной из первых органелл клетки, которая испытывает воздействие 2 H2 O, и тем самым компенсирует реалогические параметры мембраны (вязкость, текучесть, структурированность) изменением количественного состава липидов.
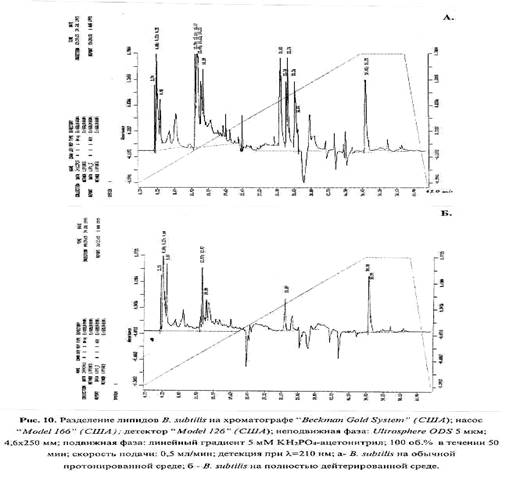
В общих чертах, при попадании клетки в дейтерированную среду из неё не только исчезает протонированная вода за счет реакции обмена Н2 О - 2 H2 О, но и происходит очень быстрый изотопный (1 Н-2 H)-обмен в гидроксильных, карбоксильных, сульфгидрильных и аминогруппах всех органических соединений, включая нуклеиновые кислоты, липиды, белки и сахара. Известно, что в этих условиях только С-Н связь не подвергается изотопному обмену и вследствие этого только соединения со связями типа С-2 H могут синтезироваться de novo [34]. Кроме вышеобозначенных эффектов, возможное изменение соотношения основных метаболитов в процессе адаптации к тяжелой воде также может негативно сказываться на рост клетки. Также не исключено, что эффекты, наблюдаемые при адаптации к 2 H2 О связаны с образованием в 2 H2 O конформаций молекул с иными структурно-динамическими свойствами, чем конформаций, образованных с участием водорода, и