Статья: Изучение биосинтеза аминокислот штаммом Вrevibacterium methylicum при росте на средах, содержащих тяжелую воду и дейтеро-метанол
Московская государственная академия тонкой химической технологии им. М.В. Ломоносова, г. Москва, просп. Вернадского, д.86.
Представлены данные по биосинтезу дейтерий-меченных аминокислот L-фенилаланин-продуцирующим штаммом факультативных метилотрофных бактерий B. methylicum. Аминокислоты разной степени изотопной замещенности на дейтерий, как секретируемые в культуральную жидкость в процессе ферментации штамма-продуцента, так и в составе гидролизатов суммарных белков биомассы, были получены за счет биоконверсии СН3 ОН/CD3 OD на средах, содержащих различные концентрации тяжелой воды, включая 24,5 об. % D2 O вплоть до 98 об.% D2 O. Для изучения степеней включения дейтерия в аминокислоты использовали метод масс-спектрометрии электронного удара метиловых эфиров N-диметиламино-5-нафталин-сульфонильных (дансильных) производных аминокислот. Степени изотопного включения дейтерия в фенилаланин, секретируемый в культуральную жидкость и в составе гидролизатов суммарного белка изменяются от 27,5 до 95 % в зависимости от концентрации D2 O в среде. Показано, что при ферментации наряду с основным продуктом биосинтеза (фенилаланин) в культуральной жидкости накапливаются другие аминокислоты , такие как аланин, валин и лейцин (изолейцин).
ВВЕДЕНИЕ
Метод мечения стабильными изотопами является ключевым направлением в разнопрофильных биохимических исследованиях с использованием аминокислот и других биологически активных соединений (БАС) [1,2]. Тенденции к предпочтительному применению стабильных изотопов, в частности, дейтерия по-сравнению с радиоактивными аналогами обусловлены такими их преимуществами, как отсутствием радиационной опасности и возможностью определения локализации метки в молекуле прямыми методами. Интенсивное развитие изотопно-чувствительной техники, прежде всего спектроскопии ядерного магнитного резонанса (ЯМР), инфракрасной и лазерной спектроскопии и масс-спектрометрии (МС), за последние годы позволило значительно усовершенствовать проведение многочисленных биологических исследований de novo, а также изучать структуру и механизм действия клеточных БАС на молекулярном уровне [3,4].
Начиная с первых экспериментов Катца с соавт. [5] по культивированию микроводорослей Chlorella на тяжелой воде продолжаются разработки методических подходов по получению БАС, в том числе аминокислот, меченных дейтерием. Потребности в дейтерированных аминокислотах обусловлены их важной ролью в разнообразных биохимических и медицинских исследованиях, а также возможностью их использования в синтезах широкого круга дейтерированных БАС, например, в синтезах пептидных гормонов и нейротрансмиттеров с использованием L-фенилаланина [6-8].
В настоящее время биотехнологический потенциал метилотрофных бактерий для получения аминокислот, меченных стабильными изотопами, в частности, дейтерием, общепризнан [9]. Современные методы мутагенеза и селекции открывают широкие перспективы для получения новых С1 -утилизирующих штаммов-продуцентов аминокислот, пригодных для роста на D2 O. В связи с этим, большой практический интерес представляет исследования процессов биосинтеза аминокислот генетически маркированными штаммами метилотрофных бактерий, которые устойчивы к высоким концентрациям дейтерия в ростовых средах.
Раннее нами была изучена возможность использования штамма факультативных метилотрофных бактерий B. methylicum для получения дейтерированного фенилаланина [10]. В отличие от традиционных штаммов-продуцентов фенилаланина, у которых нарушены активности префенатдегидратазы или дезоксиарабиногептулозофосфатсинтетазы, уникальность этого штамма состоит в том, что для биосинтеза L-фенилаланина необходим L-лейцин.
Целью настоящей работы было изучение уровней включения дейтерия в молекулы аминокислот штамма B. methylicum как секретируемых в культуральную жидкость, так и аминокислот в составе белковых гидролизатов биомассы этих бактерий на средах с различным содержанием СН3 ОН/CD3 OD и D2 O в них.
УСЛОВИЯ ЭКСПЕРИМЕНТА .
Бактериальные штаммы . Исследования проводили с L-лейцин-зависимым штаммом факультативных метилотрофных бактерий B. methylicum, продуцентом L-фенилаланина. Штамм был получен из коллекции культур Всероссийской коллекции промышленных микроорганизмов (ВКПМ) Государственного научно-исследовательского института генетики и селекции промышленных микроорганизмов.
Для приготовления питательных сред с различным содержанием дейтерия в них (см. табл.1) использовали безводные соли квалификации “х.ч.”, D2 O (99,9% D) и СD3 ОD (97,5 %D), полученные из Российского научно-исследовательского центра “Изотоп” (Санкт-Петербург, РФ). По необходимости тяжелую воду очищали от вредных примесей, перегоняя ее над перманганатом калия. Для получения производных аминокислот использовали N-диметиламинонафталин-5-сульфохлорид (дансилхлорид) (Sigma, CША) и диазометан. Диазометан получали из N-нитрозометилмочевины (Мerck, Германия).
Культивирование штамма В. methylicum проводили на минимальных средах М9 [11] как описано в работе [10].
Экстракцию липидов проводили смесью хлороформ-метанол (2:1) по методу Блайя и Дайера [12].
Щелочной гидролиз белка . Белок (4-5 мг) гидролизовали в запаянных стеклянных ампулах в 5 мл 4 н. Ba(OH)2 в течение 24 ч при 110 0 С. Гидролизаты суспендировали в 20 мл горячей дист. воды и нейтрализовали 2 н. раствором H2 SO4 с последующим отделением осадка центрифугированием (10 000 об/мин, 5 мин). Гидролизаты упаривали в роторном испарителе при 400 С.
Получение дансиламинокислот культуральной жидкости . К 200 мг лиофилизованных препаратов культуральной жидкости в 5 мл 2 м. NaHCO3 (2 10-3 моль) рН 9-10 дробными порциями при перемешивании добавляли 320 мг (1,2 10-3 моль) дансилхлорида в 5 мл ацетона. Реакционную смесь выдерживали при перемешивании при 400 С в течении часа, затем подкисляли 2 м. раствором HCL до рН 3,0 и экстрагировали этилацетатом (3 раза по 5 мл). Объединенный экстракт промывали водой до значения рН 7,0, сушили безводным сульфатом натрия, растворитель удаляли при 10 мм. рт. ст.
Дансиламинокислоты в составе белковых гидролизатов B. methylicum получали как описано в работе [9].
![]()
![]() Получение метиловых эфиров дансиламинокислот . К 20 мл 40 %-ного КОН в 40 мл эфира добавляли 3 г влажной нитрозометилмочевины и перемешивали на водяной бане со льдом в течении 15-20 мин. После интенсивного газовыделения эфирный слой отделяли и промывали ледяной водой до рН 7,0, сушили безводным NaSO4 и обрабатывали им препараты дансилпроизводных аминокислот в составе культуральной жидкости и гидролизатов белка биомассы.
Получение метиловых эфиров дансиламинокислот . К 20 мл 40 %-ного КОН в 40 мл эфира добавляли 3 г влажной нитрозометилмочевины и перемешивали на водяной бане со льдом в течении 15-20 мин. После интенсивного газовыделения эфирный слой отделяли и промывали ледяной водой до рН 7,0, сушили безводным NaSO4 и обрабатывали им препараты дансилпроизводных аминокислот в составе культуральной жидкости и гидролизатов белка биомассы.
Количественное определение L-фенилаланина в культуральной жидкости проводили на спектрофотометре“Beckman DU-6” (США) при 540 нм после обработки препаратов культуральной жидкости нингидрином, как указано в работе [10].
Масс-спектры электронного удара производных аминокислот получены на приборе “MB-80A” (Hitachi, Япония) при энергии ионизирующих электронов 70 эВ.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ .
Получение дейтерий-меченных аминокислот и их масс-спектрометрический анализ .
Данные по росту штамма B. methylicum и максимальному уровню накопления фенилаланина в культуральной жидкости на средах с 2 об.% СН3 ОН (СD3 OD), содержащих ступенчато увеличивающиеся концентрации D2 O представлены в таблице 1. Как видно из данных таблицы, рост исследуемых бактерий на средах с возрастающими концентрациями тяжелой воды сопровождался изменением выходов биомассы, времени клеточной генерации и продолжительности лаг-фазы при сохранении способности синтезировать и накапливать фенилаланин в культуральной жидкости. Поэтому было необходимо изучить, как изменяются степени включения дейтерия в фенилаланин и аминокислотные остатки суммарных белков биомассы B. methylicum в этих условиях.
ТАБЛИЦА 1.
Влияние изотопного состава среды на рост штамма B. methylicum и уровень накопления L-фенилаланина в культуральной жидкости.
|
Номер Компоненты среды, об% Величина Выход Время ген. опыта лаг-фазы биомассы часы секреции Н2 О 2 Н2 О СН3 ОН С2 Н3 О2 Н часы % L-Phe, | ||||||||
| 1 | 98 | 0 | 2 | 0 | 24,0 | 100 | 2,2 | 100 |
| 2 | 98 | 0 | 0 | 2 | 30,3 | 92,3 | 2,4 | 99,1 |
| 3 | 73,5 | 24,5 | 2 | 0 | 32,1 | 90,6 | 2,4 | 96,3 |
| 4 | 73,5 | 24,5 | 0 | 2 | 34,7 | 85,9 | 2,6 | 97,1 |
| 5 | 49,0 | 49,0 | 2 | 0 | 40,5 | 70,1 | 3,0 | 98,0 |
| 6 | 49,0 | 49,0 | 0 | 2 | 44,2 | 60,5 | 3,2 | 98,8 |
| 7 | 24,5 | 73,5 | 2 | 0 | 45,8 | 56,4 | 3,5 | 90,4 |
| 8 | 24,5 | 73,5 | 0 | 2 | 49,0 | 47,2 | 3,8 | 87,6 |
| 9 | 0 | 98,0 | 2 | 0 | 60,5 | 32,9 | 4,4 | 79,5 |
| 10 | 0 | 98,0 | 0 | 2 | 64,4 | 30,1 | 4,9 | 71,5 |
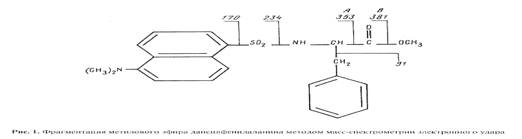
Для определения степени включения дейтерия в аминокислоты методом масс-спектрометрии электронного удара использовали метиловые эфиры дансил-аминокислот, которые химически стабильны и дают интенсивные пики молекулярных ионов в масс спектрах [13]. В качестве примера на рис.1 показана фрагментация метилового эфира дансилфенилаланина при электронном ударе. В масс-спектрах этого производного, как правило, четко детектируется пик молекулярного иона метилового эфира дансилфенилаланина М+. с m/z 412. Пик аминного фрагмента А имеет невысокую интенсивность, а пик аминоацильного фрагмента В крайне низкую или вообще отсутствует (см. рис. 1). Интенсивности пиков аминных А и аминоацильных В фрагментов других производных аминокислот, например присутствующих в культуральной жидкости аланина, валина и лейцина (изолейцина) при электронном ударе также сопоставимы. Кроме вышеобозначенных пиков, в масс-спектрах электронного удара метиловых эфиров дансил-аминокислот фиксируются пики с m/z 250, 234, 170, которые соответствуют дансильному фрагменту и продуктам его распада до N-диметиламинонафталина.
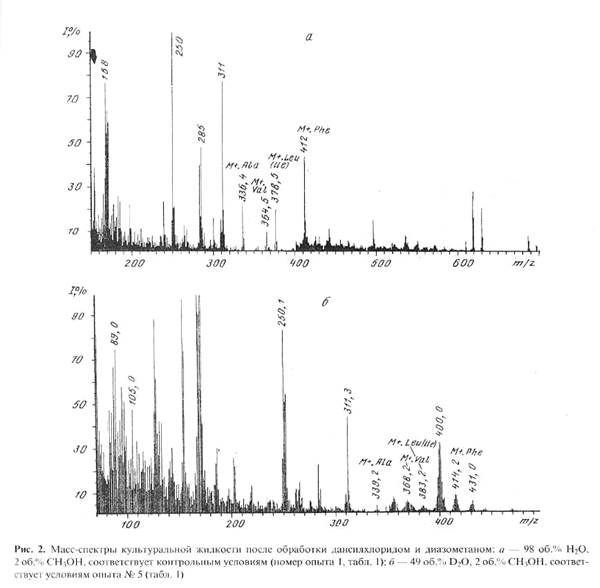
Модификация метода получения метиловых эфиров дансил-аминокислот заключалась в прямой обработке препаратов культуральной жидкости, полученной после отделения клеток, дансилхлоридом и диазометаном. В результате применения этого подхода удалось получить чётко интерпретируемые масс-спектры электронного удара метиловых эфиров дансил-аминокислот в присутствии следовых количеств низкомолекулярных метаболитов среды и сопутствующих аминокислот не прибегая к их предварительному хроматографического разделению и очистке. Следует отметить, что в условиях проведения дансильной дериватизации, для основной аминокислоты лизина характерно образование ди-дансильных производных, а для тирозина также происходит дополнительное дансилирование по гидроксильной -ОН-группе. При этерификации аминокислот диазометаном не исключено дополнительное N-метилирование по а-NH2 -группе аминокислот, что приводит к появлению в масс-спектре метиловых эфиров дансил-аминокислот пиков, соответствующих соединениям с молекулярной массой на 14 массовых единиц больше исходных [14]. В качестве примера на рис. 2,б приведен масс-спектр секретируемого фенилаланина и сопутствующих аминокислот в составе дериватизированной культуральной жидкости в условиях эксперимента 5 (см. табл.1, опыт 5), где концентрация D2 О в среде достигает 49 об.% (спектр приведен относительно контрольных условий (а), где использовали обычную воду и метанол). Из рис.2,б видно, что в этих условиях величина пика молекулярного иона производного фенилаланина (М+. с m/z 414,2) увеличивается по сравнению с контрольными условиями (М+. с m/z 412,0) на 2,2 единицы, что составляет 27,5 % от общего количества атомов водорода в молекуле. Пик с m/z 400, зафиксированный в масс-спектре культуральной жидкости (рис.2,б) вероятнее всего соответствует продукту отщепления метильной группы -СН3 от дейтерированного производного фенилаланина.
Масс-спектр культуральной жидкости, полученной на среде, содержащей 73,5 об.% D2 О и 2 об. % СН3 ОН после обработки дансилхлоридом и диазометаном представлен на рис. 3,а. Присутствие в масс-спектре этого образца пика молекулярного иона метилового эфира дансил-фенилаланина с М+. с m/z 416,1 (вместо 412 в контроле) указывает на увеличение массы фенилаланина на 4,1 единицу, т.е., 51,2 % атомов в молекуле фенилаланина замещены на дейтерий (рис. 3,а). Необходимо подчеркнуть, что вышеобозначенные атомы дейтерия включаются в молекулу фенилаланина за счет процесса биосинтеза de novo, т. е. по углеродному скелету молекулы, так как маловероятно, что они заместились в в ходе выделения аминокислоты из культуральной жидкости или при химической модификации фенилаланина. Что касается протонов (дейтеронов) при гетероатомах в NH2 -, NH-, и -COOH группах аминокислот, то они за счёт лёгкости диссоциации легко обмениваются на дейтерий даже при растворении аминокислот в D2 O. Так как все этапы, связанные с обработкой культуральной жидкости, содержащей дейтерий и её химической модификации проводились с использованием немеченных компонентов, растворителей и в т.ч. водных растворов, то эти протоны(дейтероны) из-за лёгкости диссоциации труднее всего поддаются точному подсчёту и контролю. Это могло служить причиной небольшого расхождения результатов при подсчёте степеней дейтерированности аминокислот.
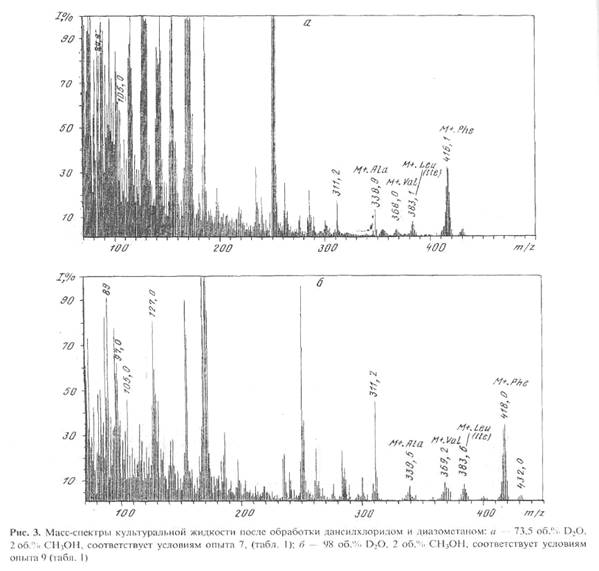
Во всех исследуемых образцах культуральной жидкости B. methylicum кроме основной секретируемой аминокислоты (фенилаланин), обнаружены примеси (на уровне 3-5 мМ) метаболически связанных с ним аланина, валина и лейцина (изолейцина) (см., например рис 3,а). Как видно из рис.3,а, изотопный состав аланина характеризовался увеличением молекулярной массы на 2,5 единицы, валина-3,5 единицы, а лейцина (изолейцина)-4,6 единицами. Таким образом, в отличие от фенилаланина, количество включенного дейтерия в последних трех аминокислотах сохраняет стабильное постоянство в довольно широком интервале концентраций D2 O в среде (от 49 об.% до 98 об.%).
Контроль за включением дейтерия в фенилаланин за счет ассимиляции дейтерометанола при росте бактерий на среде, содержащей обычную воду и 2% СD3 OD (соответствуют опыту 2, табл.1) показал незначительное количество дейтерия, которое поступает в молекулу фенилаланина вместе с углеродом СD3 OD. Процент дейтерирования фенилаланина был оценен по величине пика 413 за вычетом вклада пика примеси природного изотопа (не более 4 %, масс-спектр не приведён). Полученный результат может быть обусловлен разбавлением дейтериевой метки за счёт протекания как биохимических процессов, связанных с распадом дейтеро-метанола при его усвоении клеткой, так и реакциями изотопного обмена и диссоциации. Например, из четырёх атомов дейтерия, имеющихся в молекуле СD3 OD, лишь атом дейтерия при гидроксильной группе --OD самый подвижный и поэтому легко диссоциирует в водной среде с образованием СD3 OH. Три оставшихся атомов дейтерия в составе СD3 OH входят в цикл ферментативного окисления метанола, который также мог привести к потере дейтерия за счёт образования соединений более окисленных, чем метанол. В частности, полученный результат по уровню включения дейтерия в фенилаланин подтверждает классическую схему ферментативного окисления метанола до формальдегида в клетках метилотрофов, который лишь после этого ассимилируется у данного штамма метилотрофных бактерий рибулозомонофосфатным путем фиксации углерода [15].
Так как базовый штамм продуцент фенилаланина был ауксотрофом по лейцину, то очевидно, что уровни включения дейтерия в секретируемый L-фенилаланин на фоне максимальных концентраций тяжелой воды, могут быть ниже теоретически допустимых, вследствие функционирования в клетке ряда биохимических реакций, связанных с ассимиляцией протонированного L-лейцина извне. Отмеченная особенность проявляется при биосинтезе L-фенилаланина на дейтерированной среде, в которой помимо метанола источником дополнительных протонов является немеченный лейцин. Так, в фенилаланине, полученном со среды, содержащей 98 об.% D2 О и 2 об.% СН3 ОН, только шесть атомов (из восьми обсуждаемых) в молекуле биосинтетически замещены на дейтерий (М+. с m/z 418 вместо 412) (Масс-спектр приведён на рис. 3,б). Эти два незамещенные атома водорода могли происходить из лейцина и метанола, однако авторы не исключают, что подобный эффект является результатом не ассимиляции протонированных субстратов, а вкладом протонов солей в составе ростовой среды. Следует подчеркнуть, что в этом масс-спектре фиксируется пик обогащённого дейтерием бензильного фрагмента с m/z 97 (вместо 91 в контроле), что указывает на то, что местами локализации атомов дейтерия в молекуле фенилаланина являются положения С1-С6 ароматических атомов и сопредельное с ними положение при углеродном атоме b. Причем, как миниум четыре из них могут быть локализованы в самом бензольном кольце молекулы фенилаланина.
Масс-спектрометрический анализ смесей дейтерий меченных аминокислот белковых гидролизатов B. methylicum.
--> ЧИТАТЬ ПОЛНОСТЬЮ <--