Учебное пособие: Гази у зовнішньому силовому полі та основи термодинаміки
2.ККД ідеальної теплової машини має максимальне значення, яке менше від 1, а для реальної ККД – завжди менший ККД циклу Карно.
Поняття про ентропію
Відомо, що внутрішня енергія тіла або системи складається з енергії всіх видів внутрішнього руху в тілі і енергії взаємодії усіх частинок цього тіла або системи. При цьому внутрішня енергія U є однозначною функцією стану тіла або системи. З другого закону термодинаміки випливає, що існує і друга величина, що характеризує однозначно стан термодинамічної системи – це ентропія S.
Щоб пояснити зміст поняття ентропії, розглянемо ізотермічний процес, в якому тіло одержує теплоту Q від нагрівника з температурою Т. Тоді відношення теплоти Q, одержаної в ізотермічному процесі, до температури Т, при якій здійснюється теплопередача, називають приведеною теплотою Q і ![]() .
.
При нагріванні ![]() , то при охолодженні
, то при охолодженні ![]() . Якщо процес неізотермічний, то його розбивають на такі нескінченно малі ділянки, на яких
. Якщо процес неізотермічний, то його розбивають на такі нескінченно малі ділянки, на яких ![]() , і тоді на цій малій ділянці
, і тоді на цій малій ділянці
![]() .
.
Для довільного процесу із стану А1 і В /рис. 1б/ одержимо
![]() ,
,
для оборотного колового процесу А а В б А:
![]() .
.
Можна показати, що для будь-якого оборотного циклу /процес, при якому система з початкового стану переходить в інший і знову повертається в попередній стан без змін не тільки в системі, а і в навколишньому середовищі/. Приведена теплота дорівнює нулю:
![]() .
.
Це означає, що ![]() є повним диференціалом деякої оборотної функції:
є повним диференціалом деякої оборотної функції:
Функція, диференціал якої дорівнює приведеній теплоті, називають ентропією системи – це однозначна функція, що характеризує стан системи. Якщо dQ >0 , то і dS >0 – тіло нагрівається і його ентропія зростає, і навпаки.
Розглянемо важливіші властивості ентропії:
1. Ентрорпія системи, що здійснює оборотний цикл, не змінюється:
![]() ;
; ![]() .
.
2. Ентропія замкненої системи при будь-яких процесах в ній не зменшується D S ³ 0 . Знак рівності відноситься до оборотних, а знак нерівносі – до необоротних процесів.
Для приклада обчислимо зміну ентропії ідеального газу. За першим законом термодинаміки ![]() і тоді
і тоді
![]() ,
,
де ![]() ,
,
а ![]() .
.
Враховуючи рівняння ![]() , одержимо:
, одержимо:
![]() ,
,
і тоді
![]() .
.
При переході із стану 1 в стан 2 зміна ентропії дорівнює:
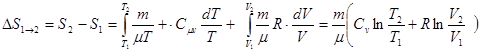 .
.
Таким чином, зміна ентропії ідеального газу не залежить від виду процесу переходу 1®2, а залежить тільки від початкового /V1 , Т1 / і кінцевого стану / V2 , Т2 / газу.