Учебное пособие: Технологические расчеты в бродильных производствах
где G С a — содержание в воде ионов кальция, мг–экв/л; Щ0 — общая щелочность, мг–экв/л.
Вода, имеющая Пщ < 1, повышает рН затора, а имеющая Пщ > 1 — понижает. При значениях Пщ близких к единице, вода считается пригодной для технологических целей.
Остаточная щелочность. Поскольку ионы Са2+ и Mg2+ способны компенсировать отрицательное воздействие углекислых солей, в воде для пивоварения важно учитывать не общее количество карбонатов, а то их количество, которое остается в свободном состоянии после частичной компенсации ионами кальция и магния. Это количество называется остаточной щелочностью и определяется по формуле
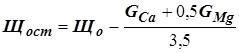 , (10)
, (10)
где GMg — содержание в воде ионов магния, мг–экв/л; остальные обозначения те же, что и в формуле (9).
Для светлых сортов пива используют воду с остаточной щелочностью не более 0,54 мг–экв/л.
Отношение ионов Са2+ / Mg 2+ . В пивоварении обращают внимание не только на общее содержание ионов кальция и магния в воде, но и на их отношение. При этом предпочтение отдается ионам Са2+ , а ионы Mg2+ могут содержаться в минимальных количествах или даже полностью отсутствовать. Отношение концентрации ионов кальция и магния в воде рассчитывается в мг–экв/л. Предельное значение отношения 1:1. Оптимальное — 4:1. При значениях отношения Са2+ /Mg2+ ниже предельного пиво может иметь неприятный вкус.
Содержание ионов , оказывающих влияние на технологический процесс и органолептические показатели пива. Дополнительные требования по ионному составу воды установлены технологической инструкцией по водоподготовке для производства пива и безалкогольных напитков (ТИ 10–5031536–73–90).
Таблица 5. Требования к качеству воды в пивоварении
| Показатель | Значение | Показатель | Значение |
| рН | 6,0–6,5 | Магний, мг/л | следы |
| Окисляемость, мг О2 /л | 2 | Марганец, мг/л | 0,1 |
| Щелочность, мг–экв/л | 0,5–1,5 | Медь, мг/л | 0,5 |
| Общая жесткость, мг–экв/л | 2–4 | Цинк, мг/л | 5,0 |
| Катионы: | Анионы: | ||
| Алюминий, мг/л | 0,5 | Нитраты, мг/л | 10 |
| Железо (суммарно), мг/л | 0,1 | Нитриты, мг/л | 0 |
| Кальций, мг–экв/л | 2–4 | Сульфаты, мг/л | 100–150 |
| Кремний, мг/л | 2 | Хлориды, мг/л | 100–150 |
1.3.2. Задания и задачи
1. Вода содержит 150 мг/л ионов кальция и 40 мг/л ионов магния. Рассчитать ее кальциевую и магниевую жесткость в мг–экв/л и ммоль/л. Определить общую жесткость воды и отнести воду к определенному типу по жесткости.
2. Общая жесткость воды составляет 5,2 мг–экв/л, содержание ионов магния в ней 20 мг/л, а общая щелочность 3,4 мг–экв/л. К какому типу жесткости относится данная вода? Рассчитать пригодность воды по щелочности. Для приготовления каких сортов пива эту воду можно использовать без предварительной водоподготовки?
3. Вода содержит 50 мг/л ионов кальция и 10 мг/л ионов магния, а общая щелочность ее составляет 4 мг–экв/л. Какое влияние эта вода будет оказывать на вкусовые качества пива? К какому типу жесткости относится данная вода?
1.3.3. Пример
Вода содержит 280 мг/л ионов кальция и имеет общую щелочность 17,5 мг–экв/л. Сколько мл соляной кислоты концентрацией 37% и плотностью 1,19 г/см3 нужно добавить к 1 м3 такой воды, чтобы довести показатель пригодности по щелочности до единицы?
Решение. Кальциевая жесткость воды составляет
![]() мг–экв/л.
мг–экв/л.
Пригодность по щелочности вычислим по формуле (9).
![]() .
.
Превышение щелочности над содержанием ионов кальция составляет
17,5 – 13,97=3,53 мг–экв/л.
Для того чтобы довести показатель пригодности воды по щелочности до единицы, необходимо избыток щелочности нейтрализовать кислотой. Поскольку вещества реагируют в эквивалентных количествах, для связывания щелочности требуется
3,53∙36,5=128,845 мг соляной кислоты,
где 36,5 — эквивалент соляной кислоты.
Товарная соляная кислота содержит 37% НСl, то есть потребуется
![]() мг кислоты.
мг кислоты.
Требуемый объем кислоты на нейтрализацию избыточной щелочности в 1 л воды составит
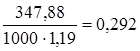 мл, т.е. 292 мл на 1 м3 .
мл, т.е. 292 мл на 1 м3 .
1.4. Контрольные задания и задачи