Дипломная работа: Нарушение экспрессии D-глюкуронил С5-эпимеразы как возможная причина изменения структуры протеогликанов в опухоли молочной железы человека
Рис.3. Структура линкерного района протеогликанов
У кератансульфат протеогликанов линкерный район имеет разветвленное строение. Цепи ГАГ присоединяются к коровому белку либо через остаток аспарагина (N-гликозилирование) - КС I (рис.4), либо через остаток серина/треонина (О-гликозилирование) – КС II.
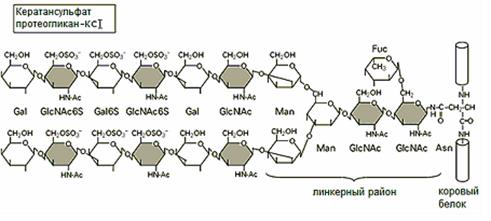
Рис.4. Структура линкерного района кератансульфат протеогликанов
1.6 Гиалуроновая кислота
Повторяющаяся дисахаридная единица гиалуроновой кислоты - GlcNAc-GlcUA. ГК широко распространена в природе, от капсул Streptococcus дотканей беспозвоночных и позвоночных организмов [3]. У млекопитающих ГК присутствует в коже, скелетной ткани, стекловидном теле глаза, пупочном канатике и синовиальной жидкости [4].
Типичный полимер может содержать 104 дисахаридных единиц (от 105 до107 Да) [5].
В растворе ГК имеет вытянутую структуру - будучи растянутым, полимер 106 Да имеет длину около 2 мкм. Благодаря своей длине, молекулы ГК стремятся образовать запутанную ситоподобную структуру. При концентрации 10 мг/мл вязкость (η) ГК составляет 5000 (т.е. в 5000 раз превышает вязкость воды), что придает упругость тканям, в которых гиалуроновая кислота присутствует в высокой концентрации (гребень петуха, стекловидное тело и др.). ГК является биологическим любрикантом - уменьшает трение при движении и обеспечивает упругость в статических условиях, участвует в поддержании гомеостаза воды, является своего рода фильтром и регулирует распределение белков плазмы [3].
Поскольку ГК имеет однородную структуру, может показаться, что она не принимает участия в специфических взаимодействиях. Однако это не так: обнаружена группа белков (гиаладгеринов), специфично узнающих структуру ГК. Такого типа взаимодействия связывают ГК с протеогликанами, стабилизируя структуру внеклеточного матрикса, и с клеточными поверхностями, изменяя поведение клеток [3].
Биосинтез ГК представляет собой кополимеризацию GlcNAcи GlcUA, донорами которых выступают высокоэнергетические нуклеотидные предшественники: UDP-GlcNAcи UDP-GlcUA, соответственно. В отличие от остальных гликозаминогликанов, ГК никогда ковалентно не присоединяется к белку. Биосинтез ГК происходит в плазматической мембране, что является исключением из правила, гласящего, что гликозилирование осуществляется в аппарате Гольджи [5, 6].
Катаболизируется ГК в лизосомах после рецептор-опосредованного эндоцитоза, на месте или же (после транспорта с током лимфы) в лимфатических узлах, где деградируется основная доля ГК [3].
1.7 Хондроитинсульфат протеогликаны
Хондроитинсульфаты представляют собой линейные полимеры, состоящие из повторяющихся дисахаридных единицGalNAc-GlcUA. В составе ДС-цепей присутствуют также остатки IdoUA (вместо GlcUA) в различных пропорциях. Количество дисахаридов в составе ХС-цепи варьирует от 40 до 100 и более штук.
Выделяют 6 классов ХС, в соответствии со структурой дисахаридных единиц: ХС А, ХС В (ДС), ХС С, ХС D, ХС Е и ХС iE (i-идуроновая кислота) (рис.5).
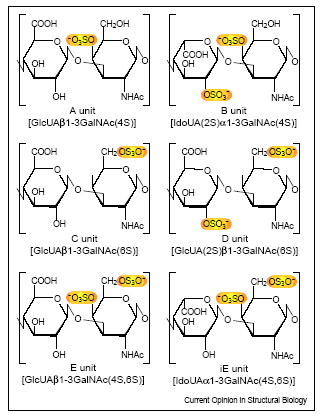
Рис.5. Шесть типичных дисахаридных единиц, обнаруженных в ХС и ДС
Огромное структурное разнообразие ХС и ДС, сравнимое с таковым у гепарансульфатов, обеспечивается включением в состав ГАГ-цепей дисахаридных единиц различной структуры и сульфатированных по различным положениям.
Такое структурное разнообразие лежит в основе широкого круга функций. ХС и ДС принимают участие в регуляции таких фундаментальных процессов, как рост, развитие, клеточная пролиферация, модулируя активность факторов роста.
ХС и ДС специфично взаимодействуют с гепарин-связывающими белками. Взаимодействия ДС-цепей с факторами роста фибробластов (FGF-2 и FGF-7) регулируют клеточную пролиферацию и заживление ран, а взаимодействия ДС с фактором роста гепатоцитов (HGF/SF) активируют HGF/SF-сигнальный путь через рецептор этого фактора роста (c-met-протоонкоген). ХС/ДС-протеогликан эндокан, секретируемый эндотелиальными клетками, стимулирует HGF/SF-индуцированную клеточную пролиферацию. Поскольку HGF/SFиграет важную роль в процессах морфогенеза, органогенеза, дифференцировки и ангиогенеза во многих типах клеток, то нарушения во взаимодействиях HGF/SFс его рецептором или же с предполагаемым корецептором ДС может привести к образованию опухоли и ее метастазированию.
ХС-цепи сходным образом взаимодействуют и с другими гепарин-связывающими белками. ХС/ДС-цепи протеогликана версикана, который экспрессируется в почках, коже, аорте, мозге, связываются, наряду с хемокинами, с адгезивными молекулами L - и P-селектинами. Все три типа молекул вовлечены в регуляцию движения лимфоцитов и резвитие воспалительных процессов [7].
Основные представители ХСПГ приведены в таблице 2.
Таблица 2. Примеры хондроитинсульфат протеогликанов
| Протеогликан | Коровый белок, кДа | Количество цепей | Ткань |
| Аггрекан | 208-220 | ~100 | cекретируемый, хрящ |
| Версикан | 265 | 12-15 | cекретируемый, фибробласты |
| Нейрокан | 145 | 1-2 | cекретируемый, мозг |
| Бревикан | 96 | 0-4 | cекретируемый, мозг |
| Декорин | 36 | 1 | cекретируемый, клетки соединительной ткани |
| Бигликан | 38 | 1-2 | cекретируемый, клетки соединительной ткани |
| Бамакан | 138 | 1-3 | базальные мембраны |
| α2 (IX) коллаген | 68 | 1 | хрящ, стекловидное тело |
| Тромбомодулин | 58 | 1 | эндотелиальная мембрана |
| CD44 | 37 | 1-4 | лимфоциты, мембранный |
| NG2 | 251 | 2-3 | нейральные клетки, мембранный |
| Инвариантная цепь | 31 | 1 | антиген-презентирующие клетки |
| Серглицин | 10-19 | 10-15 | миелоидные клетки, гранулы |
1.8 Дерматансульфат протеогликаны
ДС, также называемые хондроитинсульфатами В ( ХСВ), состоят из дисахаридных единиц D-GlcUA (L-IdоUA) - D-GalNАс. ДС относят к хондроитинсульфатам благодаря присутствиюв нихGalNAc, но из-за присутствия IdоUA их выделяют в отдельный класс ХС.
Дерматансульфат может быть рассмотрен как изомер ХС, в котором D-глюкуроновая кислота превращена в L-идуроновую. Однако полной эпимеризации всех остатков GlcUA, как правило, не происходит. Таким образом, цепи ДС являются гибридными молекулами с разными последовательностями.
Формирование L-IdoUAпроисходит путем С5-эпимеризации GlcUA, уже вошедшей в растущий полимер. Количество L-IdoUAв цепи варьирует в широких пределах - от нескольких процентов до 90% всей идуроновой кислоты. Среднее количество сульфатных групп на дисахарид в ДС выше, чем в ХС, что связано с наличием двух сульфатных групп у некоторых остатков L-IdoUA.
IdоUAиграет ключевую роль в формировании на ГАГ сайтов посадки различных ГАГ-связывающих белков. Подтверждением этого служит тот факт, что ГАГ-цепи, содержащие значительные количества остатков IdоUA, ингибируют пролиферацию нормальных фибробластов, в отличие от ГАГ с высоким содержанием остатковGlcUA.
Дерматансульфаты изучены значительно хуже других типов гликозаминогликанов. Впервые ДС были выделены из дермы, что и обусловило их название. ДС обнаружены и во многих других тканях. В высоких концентрациях они присутствуют в волокнистой соединительной ткани (в коже, сухожилиях, стенке кровеносных сосудов). ДС преобладают в коже и выделяются в высоких концентрациях в процессе заживления ран.
протеогликан белковая молекула опухоль
ДС выполняют множество функций, обеспечивая гибкое регулирование нормальных и патологических процессов, таких как развитие, рост, заживление ран, инфекция и опухолевый рост.
Различия в длине ГАГ-цепи ДС, различное положение остатков IdоUA, вариации в сульфатировании и существование множества альтернативных форм коровых белков обеспечивают огромное разнообразие и сложность ДС и ДСПГ.
Существует множество доказательств того, что различия в длине ГАГ-цепей, составе дисахаридов и сульфатировании определяют силу связывания различных факторов и регулируют функциональные взаимодействия ДС с потенциальными белковыми лигандами.