Дипломная работа: Нарушение экспрессии D-глюкуронил С5-эпимеразы как возможная причина изменения структуры протеогликанов в опухоли молочной железы человека
Дальнейший синтез заключается в последовательном присоединении гексуроновой кислоты и гексозамина [17].
По завершении синтеза линкерного района путь биосинтеза протеогликанов разветвляется. Возможно 3 альтернативных типа реакций: присоединение β-GalNAc (инициация синтеза ХС), присоединение α-GlcNAc (инициация синтеза ГС) или присоединение α-GalNAc. Эти реакции осуществляются тремя различными трансферазами. Реакция присоединения α-GalNAcк линкерному тетрасахариду нетипична для клетки и приводит к образованию пента - или гептасахарида содержащего один дисахарид ХС, который не встречается в природных протеогликанах.
Вышеупомянутые трансферазы являются важными точками контроля в биосинтезе ПГ, так как они в конечном итоге определяют тип формирующейся ГАГ-цепи [2].
Биосинтез ХС и ДС. ХС состоят из повторяющихся дисахаридных единиц GalNAc-GlcUA, полимеризованных в длинные цепи со средним размером 40 дисахаридов (~20 кДа). На основании такой структуры ХС можно предсказать, по крайней мере, 5 ферментативных активностей, включая 3 трансферазы (инициаторную GalNAcтрансферазу и полимеризующие GalNAcи GlcUAтрансферазы) и 2 сульфотрансферазы (GalNAc4-сульфотрансферазу и GalNAc6-сульфотрансферазу). Дополнительные ферменты осуществляют эпимеризацию GlcUAв IdoUAв ДС, сульфатирование С-2 уроновой кислоты и сульфатирование по другим (редко встречающимся) позициям ХС [18, 19].
После завершения синтеза углеводной цепи ХС происходит ее модификация - эпимеризация D-глюкуроновой кислоты в L-идуроновую, проводимая ферментом D-глюкуронил С5-эпимеразой (С5-EPI) и деацетилирование/сульфатирование, осуществляемое ферментом N-деацетилазой/N-сульфотрансферазой.
Эпимеризация одного или нескольких остатков GlcUAв IdoUAприводит к преобразованию ХС в ДС (рис.6).
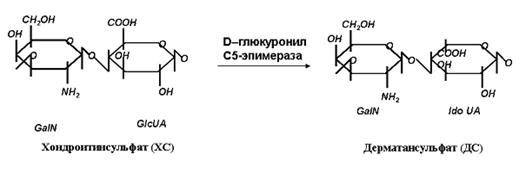
Рис.6. Реакция эпимеризации GlcUAв IdoUA
Затем сульфотрансферазы проводят сульфатирование по различным положениям (таблица 9), используя в качестве высокоэнергетического донора сульфатов PAPS (3′-фосфоаденил-5′-фосфосульфат) [20].
Таблица 9. Основные ферменты биосинтеза ХС и ДС
| Фермент | Субстрат | |
| β - галактозилтрансфераза-I | βGalNAcT-I | GlcA-Gal-Gal-Xyl-Ser |
| β - глюкуронозилтрансфераза-II | βGlcAT-II | GalNAcβ1-4GlcA-. |
| β - галактозилтрансфераза-II | βGalNAcT-II | GlcAβ1-3GalNAc-. |
| D-глюкуронил С5-эпимераза | С5-EPI | -3GalNAcβ1-GlcA b1- |
| Хондроитинсульфат-4-сульфотрансфераза | CS4-ST | -3GalNAc β1-GlcAb1- |
| Хондроитинсульфат-6-сульфотрансфераза | CS6-ST | -3GalNAc β1-GlcAb1- |
| Дераматансульфат - 6 - сульфотрансфераза | DS6-ST | -3GalNAc β1-IdoAa1- |
| Дерматансульфат - 2 - сульфотрансферза | DS2-ST | -3GalNAcβ1-IdoA a1- |
Деградация ХС и ДС в клетках животных происходит в лизосомах, где содержится несколько экзогликолитических активностей (рис.7).
Для аналитических целей широко используются бактериальные ферменты деградации ХС и ДС: хондроитиназа АС (хондроитин АС лиаза), ЕС 4.2.2.5, из Flavobacteriumheparinum, хондроитиназа АВС (хондроитин АВС лиаза), ЕС 4.2.2.4, из Proteusvulgaris. Бактериальные хондроитиназы расщепляют цепи ХС и ДС на дисахаридные единицы.
Биосинтез ГС и Ге. Углеводные цепигепарина и гепарансульфатов состоят из повторяющихся дисахаридных единицGlcNAcα1-4GlcUAβ1-4. После завершения полимеризации ГАГ-цепи ГС и Ге подвергаются серии реакций модификации, катализируемых, по крайней мере, четырьмя семействами сульфотрансфераз и одной эпимеразой [21].
Фермент GlcNAcN-деацетилаза/N-сульфотрансфераза отщепляет ацетильную группу от остатков GlcNAcи тут же присоединяет взамен ушедшей группы сульфатную, после чего образуетсяGlcNSO3 . Однако некоторые деацетилированные остатки GlcNостаются несульфатированными. Затем эпимераза, схожая с аналогичным ферментом, участвующим в биосинтезе ДС, модифицирует остатки GlcUA, непосредствннно прилежащие к GlcNSO3 . После этого происходит 2-O-сульфатирование образовавшейся IdoUA. Далее сульфотрансферазы добавляют сульфатные группы на 6-ОН остатков GlcN, прилежащих к уроновой кислоте. Наконец, сульфатированные остатки сахаров и эпимеры уроновой кислоты подвергаются действию 3-О-сульфотрансферазы.
Перечисленные модификации происходят лишь в определенных кластерах ГАГ-цепи. Таким образом, часть дисахаридных единиц преобразованиям не подвергается. Обычно реакции модификации идут в описанном выше порядке, однако полностью все этапа преобразований происходят не всегда. Это ведет к формированию огромной химической гетерогенности внутри модифицируемых регионов [10, 21].
Определенное расположение сульфатированных остатков и эпимеров уроновой кислоты в ГС и Ге формирует последовательности, с которыми связываются лиганды [10].
Основной вопрос, возникающий в данном случае, - каким образом регулируются ферменты и пути биосинтеза ГС/Ге, приводящие к формированию тканеспецифичных лиганд-связывающих последовательностей.
На данный момент выделены и клонированы практически все ферменты биосинтеза ГС. Обнаружено несколько важных особенностей, которые могут пролить свет на процесс