Доклад: Хлор
По распространенности в природе хлор близок к фтору на его долю приходится 0,02 % от общего числа атомов земной коры. Человеческий организм содержит 0,25 вес. % хлора.
Природный хлор состоит из смеси двух изотопов — 35 Сl (75,5 %) и 37 Сl (24,5 %). Он был впервые получен (действием МnО2 на соляную кислоту ) в 1774 г., но установление его элементарной природы последовало лишь в 1810 г.
Подобно фтору, основная масса хлора поступила на земную поверхность из горячих недр Земли. Даже в настоящее время с вулканическими газами ежегодно выделяются миллионы тонн и НСl и НF. Еще гораздо более значительным было такое выделение в минувшие эпохи.
Первичная форма нахождения хлора на земной поверхности отвечает его чрезвычайному распылению. В результате работы воды, на протяжении многих миллионов лет разрушавшей горные породы и вымывавшей из них все растворимые составные части, соединения хлора скапливались в морях. Усыхания последних привело к образованию во многих местах земного шара мощных залежей NаС1, который и служит исходным сырьем для получения соединений хлора.
Будучи наиболее практически важным из всех галоидов, хлор в громадных количествах используется для беления тканей и бумажной массы, обеззараживания питьевой воды (примерно 1,5 г на 1 м3 ) и в других отраслях техники. Ежегодное мировое потребление хлора исчисляется миллионами тонн.
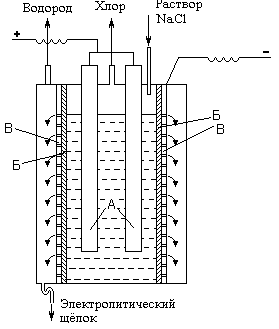
Рис. . Принципиальная схема электролизёра для получения хлора.
Основным промышленным методом получения хлора является электролиз концентрированного раствора NаС1. Принципиальная схема электролизера показана на рис. VII-5 (А - аноды, Б - диафрагма, В - катод). При электролизе на аноде выделяется хлор (2С1- - 2е- = С12 ), а в при катодном пространстве выделяется водород (2Н+ + 2е- = Н2 ) образуется NаОН.
При практическом осуществлении электролиза раствора NaCl расход электроэнергии на получение 1 т хлора составляет около 2700 кВт·ч. Полученный хлор под давлением сгущается в желтую жидкость уже при обычных температурах. Хранят и перевозят его в стальных баллонах, где он заключен под давлением около 6 атм. Баллоны эти должны иметь окраску защитного цвета с зеленой поперечной полосой в верхней части.
Для лабораторного получения хлора обычно пользуются действием MnO2 или КМnO4 на соляную кислоту:
МnО2 + 4 НСl = МnСl2 + Сl2 + 2 Н2 О
2 КМnO4 + 16 НCl = 2 КCl + 2 МnСl2 + 5 Сl2 + 8 Н2 О
Вторая реакция протекает значительно энергичнее первой (требующей подогревания).
Свободный хлор представляет собой желто-зеленый газ, состоящий из двухатомных молекул. Под обычным давлением он сжижается при -34 °С и затвердевает при -101 °С. Один объем воды растворяет около двух объемов хлора. Образующийся желтоватый раствор часто называют «хлорной водой».
Критическая температура хлора равна 144 °С, критическое давление 76 атм. При температуре кипения жидкий хлор имеет плотность 1,6 г/см3 , а теплота его испарения составляет 20,5 кДж/моль. Твердый хлор имеет плотность 2,0 г/см3 и теплоту плавления 6,3 кДж/моль. Кристаллы его образованы отдельными молекулами С12 (кратчайшее расстояние между которыми равно 334 пм).
Связь Сl-Сl характеризуется ядерным расстоянием 198 пм. Термическая диссоциация молекулярного хлора по уравнению С12 + 242 кДж Û 2 С1 становится заметной примерно с 1000 °С.
Атом хлора имеет в основном состоянии структуру внешнего электронного слоя 3s2 3р5 и одновалентен. Возбуждение его до ближайшего трехковалентного уровня 3s23р4 4s1 требует затраты
857 кДж/моль.
Энергия присоединения электрона к нейтральному атому хлора оценивается в 355 кДж/моль. Сродство к электрону хлора (аналогично и других галоидов) может быть вычислено при помощи рассмотрения реакций образования хлористых солей по отдельным стадиям. Например, для NаС1 имеем:
1) Nа (т) = Nа (г) — 109 кДж (теплота возгонки)
2) 1/2 С12 (г) = С1 (г) — 121 кДж (теплота диссоциации)
3) Na (г) = Nа+ (г) + е- — 493 кДж (энергия ионизации)
4) С1(г) + е- = Сl- (г) + Х кДж (искомое сродство к электрону)
5) Nа+ (г) + Сl- (г) = NаС1(т) +777 кДж (энергия кристаллической решетки)
в сумме: Nа(т) + 1/2 С12 (г) = NаСl(т) + (Х+777-493-121-109) кДж
С другой стороны, непосредственно определенная на опыте теплота образования NаС1 из элементов равна: Nа(т) + 1/2 С12 (г) = NаС1(т) + 410 кДж. Следовательно, по закону Гесса, Х + 777 - 493 - 121 - 109 = 410, откуда Х = 356 кДж.
Ион С1- — характеризуется эффективным радиусом 181 пм и энергией гидратации 351 кДж/моль. Для ковалентного радиуса хлора принимается половина ядерного расстояния молекулы С12 , т. е. 99 пм.
Растворимость хлора в воде меняется с температурой следующим образом:
| Температура, °С | 0 | 10 | 15 | 20 | 25 | 30 | 40 | 50 | 60 |
| Растворимость V на 1V H2 O | 4,6 | 3,1 | 2,7 | 2,3 | 2,0 | 1,8 | 1,4 | 1,2 | 1,0 |
Описаны два кристаллогидрата хлора — С12 ·6Н2 О и С12 ·8Н2 О. В действительности они могут иметь переменный состав, так как являются клатратами.
Значительно хуже (примерно в 4 раза), чем в воде, растворяется хлор в насыщенном растворе NаС1, которым поэтому и удобно пользоваться при собирании хлора над жидкостью. Наиболее пригодным для работ с ним органическим растворителем является четыреххлористый углерод (СС14 ), один объем которого растворяет при обычных условиях около 50 объемов хлора.
Основным потребителями хлора являются органическая технология (получение хлорированных полупродуктов синтеза) и целлюлозно-бумажная промышленность (отбелка). Значительно меньше потребляется хлор в неорганической технологии, санитарной технике и других областях. Интересно недавно предложенное использование хлора для обработки металлов: под его действием с достаточно нагретой (инфракрасным излучением) поверхности все шероховатости удаляются в форме летучих хлоридов. Такой метод химической шлифовки особенно применим к изделиям сложного профиля. Было показано также, что струя хлора легко прорезает достаточно нагретые листы из жаростойких сплавов.
Хлор обладает резким запахом. Вдыхание его вызывает воспаление дыхательных путей. В качестве средства первой помощи при острых отравлениях хлором применяется вдыхание паров смеси спирта с эфиром. Полезно также вдыхание паров нашатырного спирта.
Предельно допустимой концентрацией свободного хлора в воздухе производственных помещений считается 0,001 мг/л. Пребывание в атмосфере, содержащей 0,01% хлора и выше, быстро ведет к тяжелому заболеванию. Признаком острого отравления является появление мучительного кашля. Пострадавшему необходимо прежде всего обеспечить полный покой; полезно также вдыхание кислорода.
По своей характерной химической функции хлор подобен фтору — он также является одновалентным неметаллом. Однако активность его меньше, чем у фтора. Поэтому последний способен вытеснять хлор из соединений.
Тем не менее химическая активность хлора очень велика —
|
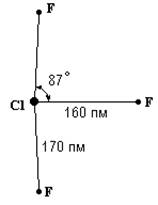
Рис. . Строение молекулы ClF3 . |
он соединяется почти со всеми металлами (иногда лишь в присутствии следов воды или при нагревании) и со всеми металлоидными элементами, кроме С, N и O. Важно отметить, что при полном отсутствии влаги хлор не действует на железо. Это и позволяет хранить его в стальных баллонах.
--> ЧИТАТЬ ПОЛНОСТЬЮ <--