Контрольная работа: Кинетика действия ферментов
Кинетические исследования ферментативных реакций необходимы не только для количественного определения ферментов и сравнения скоростей их функционирования, но, в еще большей степени, для расшифровки механизмов ферментативных реакций. В этих целях, прежде всего, необходимо уметь корректно вычислять кинетические параметры ферментативных реакций, оценивать конкурентный или неконкурентный характер действия ингибиторов. Рассмотрим основные уравнения, описывающие ферментативную кинетику и способы вычислений. Основное внимание будет уделено не строгости математического вывода уравнений, а правильному их использованию для получения достоверных результатов.
При выводе кинетических уравнений количественно характеризующих ферментативную активность, обычно делают следующие допущения.
1. Фермент и субстрат образуют фермент-субстратный комплекс за счет сил физической природы. Из этого комплекса в дальнейшем освобождаются фермент и продукт. Таким образом, химической реакцией является только второй этап – распад фермент-субстратного комплекса:
![]()
2. Концентрация субстрата обычно значительно выше концентрации фермента. Поэтому при рассмотрении начальных скоростей реакции, когда
![]()
3. Константа диссоциации определяется соотношением:
![]()
концентрация продукта очень низка, обратимостью второй стадии можно пренебречь. Следовательно, – const., а скорость образования продукта равна:
Поскольку общая концентрация фермента равна сумме концентраций свободного фермента и фермента, связанного в комплекс, то + или = –.
![]()
Подставляя значение [Е] = [Е0 ] — [ES] из (4), получаем:
![]()
С другой стороны, из уравнения следует:
![]()
В уравнении выражение к+2 можно рассматривать как максимальную скорость, достигаемую, когда концентрация фермент-субстратного комплекса численно равна общей концентрации фермента. Следовательно:
![]()
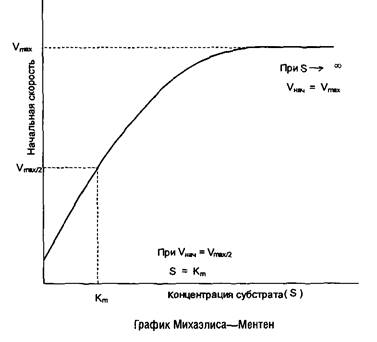
Выражение есть не что иное, как уравнение Михаэлиса–Ментен для ферментативной кинетики, а величина Кга = Ks представляет собой меру сродства фермента к субстрату. Численно она равна такой концентрации субстрата, при которой начальная скорость ферментативной реакции составляет половину максимальной скорости. Уравнение графически выражается гиперболой.
Для практического определения кинетических параметров этот график неудобен, к тому же требует использования концентраций субстрата, «насыщающих» фермент, что не всегда достижимо при ограниченной растворимости субстрата. Поэтому обычно стремятся преобразовать уравнение Михаэлиса–Ментен в такую форму, чтобы графически оно изображалось прямой линией. Чаще всего для этого используют метод Лайнуивера–Берка, представляя уравнение Михаэлиса–Ментен в виде уравнения прямой линии:

Последнее выражение называют уравнением Лайнуивера–Берка и для расчета кинетических параметров используют график, построенный в координатах: 1/V против 1/S. В результате получается прямая, отсекающая на оси ординат отрезок, равный 1/V, а на продолжении оси абсцисс отрезок, равный – 1/Кга . Однако следует отметить, что при использовании графика Лайнуивера–Берка точки в области высоких концентраций субстрата располагаются слишком густо, а положение прямой линии во многом зависит от точек в области низких концентраций субстрата, где определение скорости менее надежно. Кроме того, реальные экспериментальные данные не всегда адекватно аппроксимируются в виде прямой линии.

Поэтому предложено еще несколько приемов для определения кинетических параметров. Метод Эди–Хофсти также основан на преобразовании уравнения Михаэлиса–Ментен. Умножив обе части уравнения на и преобразовав, получим:
![]()
График этого уравнения в координатах V против V/S представляет собой прямую линию, отсекающую на осях ординат и абсцисс отрезки, равные Vmax HVm > x / Кго соответственно.
В некоторых случаях для вычисления кинетических параметров удобнее использовать метод Эйзенталя и Корниш–Боуден, основанный на преобразованном уравнении Михаэлиса–Ментен:
![]()
В этом случае для каждого значения V и S строится прямая в координатах V и S. Точка пересечения всех этих прямых имеет координаты: Vmax и Кт .
--> ЧИТАТЬ ПОЛНОСТЬЮ <--