Контрольная работа: Методы контроля и анализа веществ (химические методы)
где D— коэффициент диффузии деполяризатора, см2 /с; т —.масса ртути, вытекающей из капилляра за секунду, г/с; т — время жизни ртутной капли, с; С — объемная концентрация деполяризатора, моль/л. Для твердого микроэлектрода в отсутствие принудительно перемешивания раствора уравнение концентрационной зависимости тока принимает вид:
![]() ,
,
где S — площадь микроэлектрода, см2 ;
S — толщина диффузионного слоя, см.
Если в растворе присутствует несколько электрохимически активных соединений, на полярограмме наблюдается соответствующее число волн (рис. 5.2). Потенциалы полуволн и значения предельных диффузионных токов, зарегистрированных на такой полярограмме, совпадают с аналогичными величинами, полученными для растворов индивидуальных соединений такой же концентрации.

Рис. 5.2 Полярограмма раствора содержащего ионы Cd2+ , Zn2+ , Ni2+ , Со2+ на фоне 1М раствора KCl (1): полярограмма фона (2).
Полярограммы могут быть искажены за счет полярографических максимумов — резкого возрастания тока выше его предельного значения с последующим спадом. Причины возникновения максимумов различны, и могут быть связаны с неравномерной поляризацией ртутной капли и тангенциальным движением ее поверхности, что приводит к дополнительному перемешиванию раствора. Такого рода максимумы можно устранить введением в полярографический раствор ПАВ: красителей (метиловый красный, фуксин и др.), высокомолекулярных соединений (агар-агар, желатин).
6. (4,10-11) Рассчитайте потенциал медного электрода, опущенного в 0,2 н раствор CuCl (н.у.)
Решение:
Стандартный потенциал пары Cu+ /Cu равен 0,531 В. Можно пренебречь тем, что при нормальных условиях это значение изменится (так как это изменение будет не значительное).
Медный электрод, опущенный в раствор соли меди, является электродом первого рода, его потенциал зависит от природы потенциалопределяющей пары и концентрации катиона Сu+ (окисленной формы):
0,058
![]()
7. (5,10,11) Оптическая плотность 0,1 н раствора Cr3+ составляла А = 2,87. Измеренная в адекватных условиях оптическая плотность исследуемого раствора равнялась А = 4,25. Какова концентрация исследуемого раствора?
Решение:
![]() , где
, где ![]() молярный коэффициент поглощения;
молярный коэффициент поглощения; ![]() – толщина светопоглощающего слоя;
– толщина светопоглощающего слоя; ![]() – концентрация раствора.
– концентрация раствора.
Так как измерения проводились в адекватных условиях то можно записать
![]() ;
; ![]() и
и ![]() ; тогда
; тогда ![]()
![]()
8. (7,10) Сущность атомно-эмисссионного оптического спектрального анализа. Области его применения
Ответ:
Метод атомно-эмиссионной спектроскопии (АЭС) основан на термическом возбуждении свободных атомов или одноатомных ионов и регистрации оптического спектра испускания возбужденных атомов (рис. 8.1)
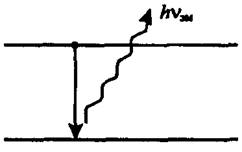
Рис. 8.1 Схема процесса лежащая в основе метода атомно-эмиссионной спектроскопии
Аналитическим сигналом в АЭС служит интенсивность испускаемого излучения ![]() . Поскольку возбуждение атомов имеет термическую природу, возбужденные и невозбужденные атомы находятся между собой в термодинамическом равновесии, положение которого описывается законом распределения Больцмана:
. Поскольку возбуждение атомов имеет термическую природу, возбужденные и невозбужденные атомы находятся между собой в термодинамическом равновесии, положение которого описывается законом распределения Больцмана:
![]()
где N0 – число невозбужденных атомов;
g* и g0 – статистические веса возбужденного и невозбужденного состояния;