Контрольная работа: Примеры решения задач по курсу химии
2AlH3 +O2 =Al2 O3 +3H2 O
SiH4 →T Si+2H2
SiH4 +2O2 =SiO2 +2H2 O
2. При растворении в соляной кислоте 5,4 г сплава алюминия с цинком объём выделившегося водорода, приведённый к н. у. составил 3,8 л. Какой процентный состав сплава?
Решение:
Пусть х – масса алюминия в сплаве, тогда:
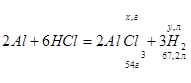
Находим V(H2 ), выделившийся при реакции Al с HCl:
x, г(Al) – y, л(H2 )
54 г(Al) – 67,2 л(H2 )
y = (67,2*x)/5,4 л.
![]()
Находим V(H2 ), выделившийся при реакции Zn с HCl:
z = ((5,4 г - x)*22,4)/65
Общий V(H2 ) при реакции сплава с HCl = 3,8 л, следовательно:
z + y = 3,8 (л), тогда находим массу Al:
(67,2 * x)/54+((5,4-x)*22,4)/64=3,8 (л).
22,4*(3x/54+(5,4-x)/64)=3,8
(22,4*46x+97,2)/1152=3,8
46x+97,2=3,8*1152/22,4
46x+97,2=195,4
46x=98,2
x = 2,14 (г) – масса алюминия.
Находим m (Zn):
5,4 – 2,14 = 3,26 (г)
W(Al) = (2,14/5,4)*100% = 39,6%
W(Zn) = (3,26/5,4)*100% = 60,4%
Ответ: состав сплава: 39,6% Al и 60,4% Zn.
3. Вычислить изменение энергии Гиббса для химической реакции: