Контрольная работа: Виробництво азотної кислоти
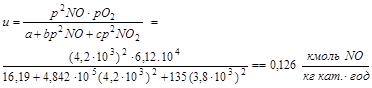
Визначимо, необхідний об'єм каталізатору:
![]()
При ступені заповнення реактора δ = 0,8, об'єм реактора складе:
![]()
3. Абсорбція оксидів азоту
3NO2 + H2 O = 2HNO3 + NO (33)
3N2 O3 + H2 O = 2HNO3 + 4NO (34)
Зневажаючи малою кількістю оксиду азоту (IV) в газі, всі розрахунки звичайно проводять по рівнянню (33). Рівновага цієї реакції вивчалося багатьма дослідниками. Якщо розглядати константу рівноваги
![]() (35)
(35)
як добуток двох приватних констант
К = К1 ∙ К2
тоді ![]() й
й ![]()
Якщо константа рівноваги До залежить, як звичайно, тільки від температури, то приватні константи рівноваги К1 і К2 залежать і від змісту кислоти в розчині.
Нижче наведений метод обчислення рівноважного складу окислів азоту над азотною кислотою заснований на наступних реакціях:
3NO2 + H2 O = 2HNO3 + NO (36)
2NO2 = N2 O4 (37)
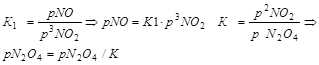
Позначивши через а, b і с парціальні тиски компонентів початкового газу, знайдемо їхні парціальні тиски в кінцевому газі:
До поглинання Після поглинання
NО ..... а K1 x3
NO2 ..... b х
N2 O4 …...c x2 /K
де х – парціальний тиск двоокису вуглецю в момент рівноваги.
Значення К визначається по рівнянню
![]() (38)
(38)
Відповідно до реакції, кількість оксиду (ІІ), що утвориться, у три рази менше кількості поглиненого оксиду азоту (IV). Розглядаючи N2 O4 як 2NO2 , одержимо
![]() або
або
![]() (39)
(39)