Курсовая работа: Электрохимия и химическая кинетика
3) Температурный коэффициент скорости; определить подчинённость правилу Вант-Гоффа;
4) Израсходованное количество вещества за время ![]() , если исходная концентрация равна С0 ;
, если исходная концентрация равна С0 ;
5) Период полураспада.
Принять, что порядок реакции и молекулярность совпадают.
![]()
К1 =0,00203;
К2 =0,000475;
Т1 =298 К;
Т2 =288 К; Т3 =338 К;
![]() ;
;
С0 =0,93 моль/л.
Решение.
Приняв, что молекулярность реакции и ее порядок совпадают, будем считать, что данная реакция есть реакция II порядка, поскольку в ее элементарном акте участвуют две молекулы.
1. Согласно уравнению Аррениуса:
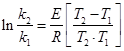 , выразив откуда энергию активации, получим:
, выразив откуда энергию активации, получим:
![]() , подставляя заданные значения констант и температур, найдём:
, подставляя заданные значения констант и температур, найдём:
![]() Дж/моль;
Дж/моль;
2. Выразим из уравнения Аррениуса константу скорости реакции:
![]() , получим:
, получим: ![]() .
.
3. Согласно уравнению Вант-Гоффа:
![]() , откуда температурный коэффициент равен:
, откуда температурный коэффициент равен:
![]()
![]()
![]()
Как видно, температурный коэффициент изменяется и не принадлежит интервалу от 2 до 4, из этого можно сделать вывод о несоответствии реакции правилу Вант-Гоффа.
4. Применяя кинетическое уравнение реакции II порядка, можно найти количество вещества, которое было израсходовано за время ![]() :
:
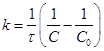 , откуда:
, откуда: ![]() - текущая концентрация эфира.
- текущая концентрация эфира.
Тогда найдем, сколько вещества прореагировало:
· при температуре 288 К: