Курсовая работа: Методи експериментальних досліджень і розрахунків кінетики хіміко-технологічних процесів
1.3.1.1 Одинична реакція першого порядку
Для процесу з одиничною реакцією першого порядку, швидкість якої виражена через ступінь перетворення
![]() (23)
(23)
інтегральна залежність має напівлогарифмічний вигляд
![]() (24)
(24)
Графічно напівлогарифмічне рівняння представляє пряму (рис. 5).
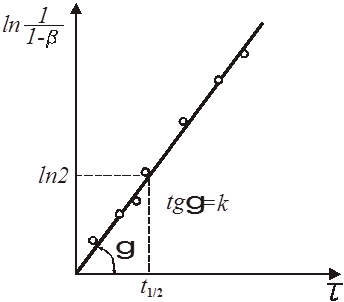
Рис. 5. Напівлогарифмічна залежність ступеня перетворення x від часу τ для реакції першого порядку
З рівняння і його графіка знаходимо:
![]() (25)
(25)
Якщо досліджувана реакція є дійсно реакцією першого порядку, то обчислене значення k не повинні змінюватися із збільшенням τ, і отже, всі точки лежатимуть на прямій.
Для попередньої оцінки величини константи швидкості реакції і придатності прийнятого рівняння можна застосувати простіший спосіб, заснований на використанні часу напівперетворення.
Час напівперетворення визначається як час, протягом якого концентрація реагуючої речовини зменшується на половину своєї первинної величини.
З напівлогарифмічного рівняння реакції першого порядку виходить, що ступінь перетворення досягає величини β= 0,5 у момент часу
![]() 1/2 (26)
1/2 (26)
де τ1/2 – час напівперетворення (рис. 5).
Очевидно, що застосування часу напівперетворення вимагає постановки дослідів при різних температурах, при яких порядок залишався б постійним, а змінювалася б тільки величина k . Якщо реакція дійсно першого порядку, то різниця у величинах констант визначатиметься тільки значеннями температури.
Іноді для відшукання константи швидкості реакції першого порядку зручно застосовувати графік експоненціальної кривої (рис.6), використовуючи для цього величину так званого характеристичного часу. Воно визначається як час, необхідне для того, щоб концентрація реагуючої речовини склала від первинної величину в 1/е разів меншу.
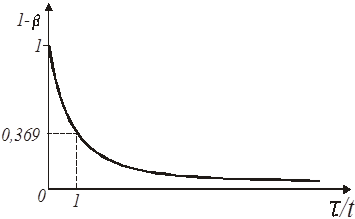
Рис. 6. Експоненціальна крива реакції першого порядку
Дійсно, переходячи від напівлогарифмічного рівняння реакції першого порядку до його експоненціального виразу одержуємо, що в мить, коли час τ досягає величини характеристичного часу t
![]() (27)
(27)
Переходячи від ступеня перетворення до концентрацій, знаходимо:
![]() (28)
(28)
Знаючи відрізок часу, протягом якого концентрація від початку відліку зменшилася в 1/е = 0,369 разу, легко визначити константу швидкості як величину зворотну характеристичному часу:
![]() (29)
(29)
Приклад 1 .