Курсовая работа: Синтез хлороформа. Реакции нуклеофильного замещения и элиминирования галогеналканов
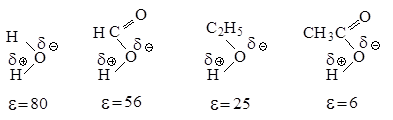
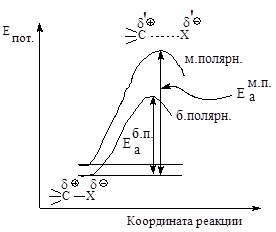
Рис.2.5. Влияние полярности растворителя на скорость реакции мономолекулярного нуклеофильного замещения
В растворителе, имеющем высокую диэлектрическую проницаемость, легче протекает ионизация галогеналкана, но, в отличие от апротонных растворителей, в протонном сольватируется не только карбокатион, но и ион галогена, образуя с ним водородные связи.
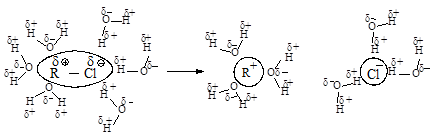
Сольватация сопровождается выделением значительного количества энергии, которая может быть затрачена на ионизацию новых исходных молекул, что приводит к ускорению реакции.
Сольватация нуклеофила не влияет на скорость реакции, так как даже стабилизированный сольватацией нуклеофил быстро реагирует с карбокатионом.
Стереохимия. В карбокатионе, образующемся в медленной стадии, связи sp 2 -гибридизованного атома углерода расположены в одной плоскости. Если SN 1-замещение протекает у хирального атома углерода, то образующийся плоский карбокатион становится ахиральным.
Последующая атака нуклеофильного реагента происходит с одинаковой вероятностью и с той и с другой стороны плоского карбокатиона. Следовательно, половина образующихся молекул будет иметь ту же конфигурацию, что и исходное соединение, а половина - будет его зеркальным изображением, т.е. образуется эквимолекулярная смесь энантиомеров - рацемат. Такая реакция приводит к оптически неактивному продукту.
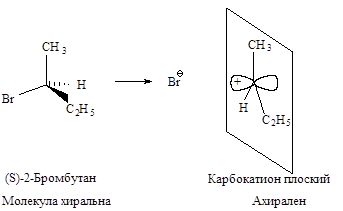

В том случае, если уходящий галогенид-ион не успевает отойти от реакционного центра, он затрудняет атаку нуклеофила со своей стороны. Это приводит к образованию большего количества изомера с конфигурацией, противоположной конфигурации исходного соединения. Тогда имеет место частичная рацемизация .
Реакционная способность. Главным фактором, определяющим реакционную способность в SN 1-реакции, является электронный фактор - устойчивость образующегося в медленной стадии реакции карбокатиона. Чем устойчивее карбокатион, тем легче он образуется, тем быстрее протекает замещение.
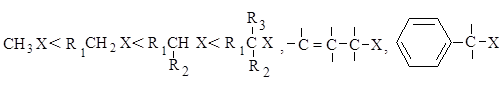
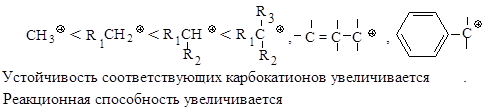
2.1.3. Сравнение реакций SN 1 и SN 2
Каждый из этих механизмов в чистом виде встречается очень редко. Реакционная способность в SN 2-реакции уменьшается при переходе от СН3 -Х к первичным RCH2 -X, для вторичных - она гораздо меньше и появляется значительный вклад SN 1-реакций. При переходе от вторичных к третичным галогеналканам реакционная способность в SN 1-реакции резко возрастает.
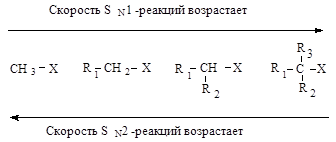
Изменяя условия протекания реакций, можно направить процесс преимущественно по тому или иному механизму.
Таблица 2.2
Влияние условий реакции на относительное значение двух механизмов
| Механизм | Растворитель | Сила нуклеофила |
Концентрация нуклеофила |
| SN 1 | Протонный | Более слабый | Меньшая |
| SN 2 | Апротонный | Более сильный | Бóльшая |
2.2. Реакции отщепления (элиминирование)
В ходе реакции элиминирования от молекулы галогеналкана отщепляются два фрагмента: ион галогена (уходящая группа) от Сa и протон - от соседнего атома углерода Сb . Такой тип реакций называется b-элиминированием.
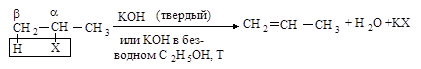
2.2.1. Бимолекулярное отщепление Е2
Реакция отщепления галогеноводорода от первичных галогеналканов протекает по бимолекулярному механизму Е2.
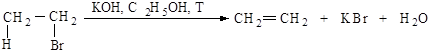
Механизм Е2. Основание НО– атакует водород (рис.2.6.а) при Сb , подает ему пару электронов и начинает образ