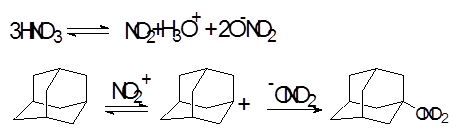Курсовая работа: Синтез нитрата адмантана
Нитроэфиры получают при определенной, обычно невысокой, температуре, поскольку повышение температуры увеличивает скорость не только этерификации, но и обратной реакции омыления, а также процессов окисления. Окислительные процессы снижают выход нитроэфиров и увеличивают опасность их производства. Повышение температуры выше определенного предела может привести к загоранию массы, вследствие прогрессивно увеличивающихся скоростей реакций этерификации и окисления. Из-за большого теплового эффекта окисления охлаждающая поверхность аппаратуры не сможет обеспечить полный отвод выделившегося тепла, температура реакционной массы будет прогрессивно растиможет достичь температуры воспламенения спирта и нитрата, что повлечет за собой взрыв.
Повышение температуры при этерификации особенно опасно для некоторых эфиров азотной кислоты, обладающих низкой стойкостью в неочищенном состоянии. Оно может вызвать саморазложение полученного продукта, которое часто ускоряется окислами азота. Саморазложение нитроэфиров, как правило, остановить охлаждением не удается, и оно оканчивается загоранием или даже взрывом.
ХИМИЧЕСКИЕ СВОЙСТВА.
1) Гидролиз
Характерным свойством нитроэфиров является их способность к гидролизу как в щелочной, так и в кислой среде:
RONO2 +H2 O![]() ROH+HNO3
ROH+HNO3
Гидролиз сопровождается образованием, наряду с основными продуктами (спирт и кислота), ряда побочных продуктов: альдегидов кетонов карбоновых кислот, ненасыщенных соединении, азотной кислоты и т.
2) Восстановление
Восстановление нитроэфиров приводит, как правило, к образованию исходного спирта и аммиака. В некоторых случаях, в зависимости от природы восстанавливающего агента, продуктами реакции могут быть N2 , NO, а также вместо спирта эфир той кислоты, в которой проводили восстановление.
3) Переэтирификация
Специфичной для нитроэфиров является реакция переэтерификации. В частности, взаимодействие их с серной кислотой приводит к замене нитрогруппы сульфогруппой:
RONO2 +H2 SO4![]() ROSO3 H+HNO3
ROSO3 H+HNO3
При нагревании нитроэфиров в уксусной кислоте, содержащей серную кислоту, кроме переэтерификации может протекать реакция, приводящая к образованию альдегидов.
4) Нитрование
Благодаря подвижности нитрогруппы, нитроэфиры способны нитровать различные органические соединения в кислой и щелочной средах Например, пиррол и индол легко нитруются этилнитратом:
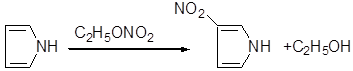
5) Интересным свойством нитроэфиров является их способность катализировать реакции полимеризации .
Например, нитроглицерин инициирует полимеризацию стирола и метилметакрилата.
ФИЗИЧЕСКИЕ СВОЙСТВА И ПРИМЕНЕНИЕ
Низкая энергия связи О—N02 в нитроэфирах (35—41 ккал/моль) по сравнению с энергиями связей С—N02 в нитроуглеводородах (52—57 ккал/моль) и N—N02 в нитраминах (41—47 ккал/моль) объясняет их низкую термическую стойкость. Температура вспышки нитроэфиров лежит в пределах 195—215 °С. Термический распад взрывчатых веществ этого класса характеризуется резким автокаталитическим ускорением и часто заканчивается взрывом. Особенно низкой стойкостью отличаются влажные продукты, плохо отмытые от кислоты. Этерификация спирта и выделение продукта реакции являются опасными операциями из-за нестойкости «кислых» нитроэфиров. В этих условиях начавшееся по тем или иным причинам разложение реакционной смеси быстро ускоряется и заканчивается вспышкой или взрывом. Нитроэфиры являются более мощными взрывчатыми веществами, чем соответствующие нитросоединения, благодаря лучшему кислородному балансу.
Все нитроэфиры токсичны. Попадание в организм приводит к расширению сосудов, головной боли, а при больших концентрациях к смерти. В небольших количествах некоторые нитроэфиры (нитроглицерин, тэн и др.) используются в медицинской практике как сосудорасширяющие средства.
ПОЛУЧЕНИЕ НИТРАТА АДАМАНТАНА.
Химические свойства адамантана впервые были представлены реакциями с бромом, серной кислотой в статьях Ланды, Штеттера, Гелука и Шлатманна.
Реакции адамантана с бромом и серной кислотой отнесены к ионным реакциям, протекающим через стадию образования адамантильного катиона. Однако сведения о действии азотной кислоты на адамантан в ранних исследованиях отсутствуют если не считать работы Смита по нитрованию адамантана смесью азотной и уксусной кислот при 140 °С с образованием моно- и динитроадамантанов.

Первое сообщение о синтезе нитратов взаимодействием адамантана с азотной кислотой относится к 1975 году. Так, реакция адамантана с избытком 96-98 %-й азотной кислоты приводит к 1-нитроксиадамантану в качестве основного продукта реакции и 1,3-динитроксиадамантану.
Несколько позднее авторы предложили для синтеза нитрата 2 использовать смесь азотной и уксусной кислот. Адамантан со смесью азотной и уксусной кислот взаимодействует с меньшей скоростью, чем с азотной кислотой, и максимальный выход нитрата 2 80% (мольное соотношение азотной и уксусной кислот 3:1, количество смеси 24 моль) достигается за 3 ч. Единственным побочным продуктом реакции является адамантанол-1.
Изучение поведения адамантана в азотной кислоте и ее смеси с уксусной кислотой [9] позволило предложить механизм образования 1-нитроксиадамантана, включающий стадию генерации адамантильного катиона.