Курсовая работа: Спирты
Структурная изомерия спиртов определяется изомерией углеродного скелета и изомерией положения гидроксильной группы.
Рассмотрим изомерию на примере бутиловых спиртов.
В зависимости от строения углеродного скелета, изомерами будут два спирта – производные бутана и изобутана:
|
|
|
|
В зависимости от положения гидроксильной группы при том и другом углеродном скелете возможны еще два изомерных спирта:
1 2 3 4
![]() 1
1
|
|
ОН ОН
Число структурных изомеров в гомологическом ряду спиртов быстро возрастает. Например, на основе бутана существует 4 изомера, пентана – 8, а декана – уже 567 [5].
Глава I. Свойства спиртов.
1.1. Физические свойства спиртов.
Физические свойства спиртов существенно зависят от строения углеводородного радикала и положения гидроксильной группы. Первые представители гомологического ряда спиртов – жидкости, высшие спирты – твердые вещества.
Метанол, этанол и пропанол смешиваются с водой во всех соотношениях. С ростом молекулярной массы растворимость спиртов в воде резко падает, так, начиная с гексилового, одноатомные спирты практически нерастворимы. Высшие спирты не растворимы в воде. Растворимость спиртов с разветвленной структурой выше, чем у спиртов с имеющих неразветвленное, нормальное строение. Низшие спирты обладают характерным алкогольным запахом, запах средних гомологов сильный и часто неприятный. Высшие спирты практически не имеют запаха. Третичные спирты обладают особым характерным запахом плесени.
Низшие гликоли – вязкие бесцветные жидкости, не имеющие запаха; хорошо растворимы в воде и этаноле, обладают сладким вкусом.
С введением в молекулу второй гидроксильной группы происходит повышение относительной плотности и температуры кипения спиртов. Например, плотность этиленгликоля при 0°С – 1,13, а этилового спирта – 0,81.
Спирты обладают аномально высокими температурами кипения по сравнению со многими классами органических соединений и чем можно ожидать на основании их молекулярных весов (Табл.1).
Таблица 1.
Физические свойства спиртов.
| Отдельные представители | Физические свойства | ||
| название | структурная формула | т. пл., °С | т. кип., °С |
| Одноатомные | |||
| Метанол (метиловый) | СН3 ОН | -97 | 64,5 |
| Этанол (этиловый) | СН3 СН2 ОН | -115 | 78 |
| Пропанол-1 | СН3 СН2 СН2 ОН | -127 | 97 |
| Пропанол-2 | СН3 СН(ОН)СН3 | -86 | 82,5 |
| Бутанол-1 | СН3 (СН2 )2 СН2 ОН | -80 | 118 |
| 2-Метилпропанол-1 | (СН3 )2 СНСН2 ОН | -108 | 108 |
| Бутанол-2 | СН3 СН(ОН)СН2 СН3 | -114 | 99,5 |
| Двухатомные | |||
| Этандиол-1,2 (этиленгликоль) | НОСН2 СН2 ОН | -17 | 199 |
| Трехатомные | |||
| Пропантриол-1,2,3 (глицерин) | НОСН2 СН(ОН)СН2 ОН | 20 | 290 |
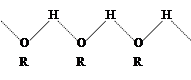 Это объясняется особенностями строения спиртов – с образованием межмолекулярных водородных связей по схеме:
Это объясняется особенностями строения спиртов – с образованием межмолекулярных водородных связей по схеме:
Спирты разветвленной структуры кипят ниже, чем нормальные спирты того же молекулярного веса; первичные спирты кипят выше вторичных и третичных их изомеров [3].
1.2. Химические свойства спиртов.
Как у всех кислородосодержащих соединений, химические свойства
спиртов определяются, в первую очередь, функциональными группами и, в
известной степени, строением радикала.
Характерной особенностью гидроксильной группы спиртов является подвижность атома водорода, что объясняется электронным строением гидроксильной группы. Отсюда способность спиртов к некоторым реакциям замещения, например, щелочными металлами. С другой стороны, имеет значение и характер связи углерода с кислородом. Вследствие большой электроотрицательности кислорода по сравнению с углеродом, связь углерод-кислород также в некоторой степени поляризована с частичным положительным зарядом у атома углерода и отрицательным – у кислорода. Однако, эта поляризация не приводит к диссоциации на ионы, спирты не являются электролитами, а представляют собой нейтральные соединения, не изменяющие окраску индикаторов, но они имеют определенный электрический момент диполя [3,4].
Спирты являются амфотерными соединениями, то есть могут проявлять как свойства кислот, так и свойства оснований.
1.2.1. Взаимодействие спиртов с щелочными металлами.
Спирты как кислоты взаимодействуют с активными металлами (K, Na, Ca). При замещении атома водорода гидроксильной группы металлом образуются соединения, называемые алкоголятами (от названия спиртов – алкоголи):
![]() 2R – OH + 2Na 2R – ONa + H2
2R – OH + 2Na 2R – ONa + H2
|
|
Названия алкоголятов производят от названий соответствующих спиртов, например,
![]() 2С2 Н5 ОН + 2Na 2С2 Н5 – ONa + H2
2С2 Н5 ОН + 2Na 2С2 Н5 – ONa + H2
| ||
| ||
| ||
Низшие спирты бурно реагируют с натрием. С ослаблением кислотных свойств у средних гомологов реакция замедляется. Высшие спирты образуют алкоголяты лишь при нагревании [4].
Алкоголяты легко гидролизуются водой:
![]() С2 Н5 – ONa + HОН С2 Н5 - ОН + NaОН
С2 Н5 – ONa + HОН С2 Н5 - ОН + NaОН