Курсовая работа: Спирты
Известны алкоголяты и других металлов, кроме щелочных, но они образуются косвенными путями. Так, щелочноземельные металлы непосредственно со спиртами не реагируют. Но алкоголяты щелочноземельных металлов, а также Mg, Zn, Cd, Al и других металлов, образующих реакционноспособные металлоорганические соединения, можно получить действием спирта на такие металлоорганические соединения.
1.2.2. Замещение гидроксильной группы спирта галогеном.
Гидроксильная группа спиртов может быть замещена на галоген действием на них галогенводородных кислот, галогенных соединений фосфора или тионилхлорида, например,
|
|
Наиболее удобно для замещения гидроксильной группы использовать тионилхлорид; применение галогенных соединений фосфора осложняется образованием побочных продуктов. Образующаяся при такой реакции вода разлагает галогеналкил на спирт и галогенводород, поэтому реакция обратима. Для ее успешного проведения необходимо, чтобы исходные продукты содержали минимальное количество воды. В качестве водоотнимающих средств применяют хлорид цинка, хлорид кальция, серную кислоту.
Данная реакция протекает с расщеплением ковалентной связи, что можно представить равенством
![]()
Скорость этой реакции возрастает от первичных к третичным спиртам, причем она также зависит от галогена: наибольшей она является для иода, наименьшей – для хлора.
1.2.3. Дегидратация спиртов (отщепление воды).
В зависимости от условий дегидратации образуются олефины или простые эфиры.
Олефины (этиленовые углеводороды) образуются при нагревании спирта (кроме метилового) с избытком концентрированной серной кислоты, а также при пропускании паров спирта над окисью алюминия при 350° - 450°. При этом происходит внутримолекулярное отщепление воды, то есть Н+ и ОН – отнимаются от одной и той же молекулы спирта, например:
|
|
![]() СН3 -СН2 -СН2 ОН СН3 -СН=СН2 +Н2 О
СН3 -СН2 -СН2 ОН СН3 -СН=СН2 +Н2 О
Простые эфиры образуются при осторожном нагревании избытка спирта с концентрированной серной кислотой. В этом случае происходит межмолекулярное отщепление воды, то есть Н+ и ОН – отнимаются от гидроксильных групп разных молекул спирта, как это показано на схеме:
|
|
|
![]() 2С2 Н5 ОН С2 Н5 -О-С2 Н5 +Н2 О
2С2 Н5 ОН С2 Н5 -О-С2 Н5 +Н2 О
Первичные спирты дегидратируются труднее вторичных, легче отнимается молекула воды от третичных спиртов [5].
1.2.4. Образование сложных эфиров спиртов .
При действии кислородных минеральных и органических кислот на спирты образуются сложные эфиры, например,
|
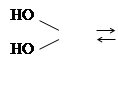 |
ROH + SO2 SO2 +H2 O
Такого рода взаимодействие спирта с кислотами называется реакцией этерификации. Скорость этерификации зависит от силы кислоты и природы спирта: с увеличением силы кислоты она возрастает, первичные спирты реагируют быстрее вторичных, вторичные спирты – быстрее третичных. Этерификация спиртов карбоновыми кислотами ускоряется при добавлении сильных минеральных кислот. реакция обратима, обратная реакция называется гидролизом. Сложные эфиры получаются также при действии на спирты галогенангидридов и ангидридов кислот.
1.2.5. Дегидрогенизация спиртов и окисление.
Образование разных продуктов в реакциях дегидрогенизации и окисления является важнейшим свойством, позволяющим отличить первичные, вторичные и третичные спирты.
При пропускании паров первичного или вторичного, но не третичного спирта над металлической медью при повышенной температуре происходит выделение двух атомов водорода и первичный спирт превращается в альдегид, вторичные спирты дают в этих условиях кетоны.
|
|
|
|
третичные спирты в тех же условиях не дегидрируются.
Такое же различие проявляют первичные и вторичные спирты при окислении, которое можно проводить "мокрым" путем, например, действием хромовой кислоты, или каталитически, причем катализатором окисления
служит также металлическая медь, а окислителем кислород воздуха:
RCH2 OH + O ® R-COH + H2 O

 CHOH + O ®C=O + H2 O
CHOH + O ®C=O + H2 O
Глава 2. Методы получения спиртов.
В свободном виде многие спирты содержатся в летучих эфирных маслах растений и вместе с тем с другими соединениями обусловливают запах многих цветочных эссенций, например, розового масла и др. Кроме того, спирты находятся в виде сложных эфиров во многих природных соединениях – в воске, эфирных и жирных маслах, в животных жирах. Наиболее распространенным и из спиртов, находящихся в природных продуктах, является глицерин – обязательная составная часть всех жиров, которые до сих пор служат главным источником его получения. К числу весьма распространенных в природе соединений относятся многоатомные альдегидо- и кетоноспирты, объединяемые под общим названием сахаров. Синтез важнейших в техническом отношении спиртов рассмотрен ниже [5].
2.1. Производство этилового спирта.
Процессы гидратации – это взаимодействие с водой. Присоединение воды в ходе проведения технологических процессов может вестись двумя методами:
1. Прямой метод гидратации осуществляется при непосредственном взаимодействии воды и сырья, используемого для производства. Этот процесс ведется в присутствии катализаторов. Чем больше атомов углерода находится в цепи, тем быстрее идет процесс гидратации.
2. Косвенный метод гидратации осуществляется при помощи образования промежуточных продуктов реакции в присутствии серной кислоты. А затем реакции гидролиза подвергаются создаваемые промежуточные продукты.
При современном производстве этилового спирта используют метод прямой гидратации этилена:
СН2 =СН2 + Н2 О « С2 Н5 ОН – Q
Получение ведется в контактных аппаратах полочного типа. Спирт отделяется из побочных продуктов реакции в сепараторе, а для окончательной очистки используется ректификация [2].
Реакция начинается с атаки ионом водорода того углеродного атома, который связан с большим числом водородных атомов и является поэтому более электроотрицательным, чем соседний углерод. После этого к соседнему углероду присоединяется вода с выбросом Н+ . Этим методом в промышленном масштабе готовят этиловый, втор-пропиловый и трет-бутиловый спирты.
Для получения этилового спирта издавна пользуются различными сахаристыми веществами, например, виноградным сахаром, или глюкозой, которая путем "брожения", вызываемого действием ферментов (энзимов), вырабатываемых дрожжевыми грибками, превращается в этиловый спирт.
С6 Н12 О6 ® 2С2 Н5 ОН + 2СО2
Глюкоза в свободном виде содержится, например, в виноградном соке, при брожении которого получается виноградное вино с содержанием спирта от 8 до 16%.