Курсовая работа: Технологія виробництва азотної кислоти
У промисловості застосовується кілька типів контактних апаратів для окислення аміаку. Однак усі вони мають приблизно однаковий принцип дії.
При підвищеному тиску встановлюють до 18 сіток. При двухстадійному контактуванні (мал. 3) число платиноїдних сіток може бути знижене до 1-3 (при підвищеному тиску).
Окислення оксиду азоту (ІІ) до діоксиду. Нітрозні гази, одержані при окисленні аміаку, містять NО і інші оксиди азоту, кисень, азот і пари води. Для одержання азотної кислоти оксид азоту (ІІ) необхідно окислити до діоксиду.
Процес окислення NО киснем повітря описують наступним сумарним (балансовим) рівнянням:
2NO+O2 ↔ 2NO2, ∆Н=-112кдж(ж)
Відповідно до принципу Ле Шателье рівновага цього процесу зміщується вправо при підвищенні тиску і зниженнітемператури. Практично утворення діоксиду азоту починається при температурі нижче 700°С, а при температурі нижче 100°С рівновага майже цілком зміщена вправо.
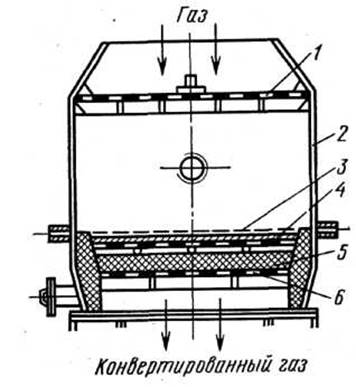
Рис. 3. Контактний апарат
1 - розподільні ґрати; 2 - корпус апарата; 3 - платиноїдна сітка; 4 - шар неплатинового каталізатора; 5 - насадка; 6-опорні ґрати
Константа швидкості процесу збільшується зі зниженням температури, що іноді розглядають як порушення закону Арреніуса. У дійсності це явище можна пояснити тим, що процес по формулі (ж) протікає в дві стадій. Спочатку відбувається швидка оборотна екзотермічна реакція димеризації оксиду азоту
2NO ↔N2 O2 (з)
а потім окислення димера по екзотермічній практично необоротній (при t<100°С) реакції
N2 O2 + О2 ↔ 2NO2 (і)
При підвищенні температури рівновага реакції (з) зміщується вліво, концентрація димера N2 O2 сильно знижується. Відповідно знижується і швидкість реакції (і)
![]()
У результаті зменшується і загальна швидкість процесу. Тому для збільшення швидкості перетворення NO у NO2 реакційну суміш енергійно охолоджують. Підвищення тиску сприяє зміщенню рівноваги по реакції (з) в бік димера і збільшенню швидкості реакції (і). Підвищується і ступінь абсорбції діоксиду азоту. Тому в останні роки у виробництві азотної кислоти перейшли від установок під атмосферним тиском до підвищеного тиску до 1 МПа.
При окислюванні оксиду азоту може протікати реакція асоціації NO2 з утворенням димера:
2NO2 ↔Ν2 О4 ∆Н = -57 кДж
Швидкість цієї реакції дуже велика, а рівновага з підвищенням тиску і зменшенням температури зміщується в праву сторону.
Таким чином, у нітрозних газах, що надходять на абсорбцію, містяться NO2 , N2 O4 , O2 , N2 O, NO, N2 O2 , N2 , пари води та ін.
Абсорбція діоксиду азоту і його димера протікає за схемами
2 NO2 + Н2 О ↔ HNO3 + HNO2 , ∆Н = - 116 кДж
N2 О2 + Н2 О ↔ HNO3 + HNO2 , ∆Н = - 59 кДж
Одержана при цьому азотиста кислота нестійка і розкладається:
3HNO2 ↔HNO3 + 2NO + Н2 О, ∆Н = 76 кДж
Тому сумарно взаємодію NO2 з водою можна представити рівнянням реакції
3NO2 +Н2 О→ 2HNO3 + NO, ∆H = - 136 кДж
Поглинання діоксиду азоту водою - типовий хемосорбциійний процес у системі газ - рідина.
У виробництві необхідно одержувати кислоту як можна вищої концентрації. При цьому збільшується пружність оксидів азоту над розчином кислоти, що знижує рушійну силу процесу і, отже, загальну швидкість процесу. Для зміщення рівноваги убік утворення HNO3 необхідно знижувати температуру, а також підвищувати тиск. При абсорбції оксидів азоту використовують принцип протипотоку, тобто більш концентрований газ кантактує з концентрованою кислотою, а наприкінці абсорбції залишки NO2 поглинаються найбільш слабкою кислотою.
Внаслідок екзотермічності процесу абсорбції температура вихідної продукційної кислоти звичайно складає не менш 50 °С, тому в установках, що працюють під атмосферним тиском, виходить кислота, що містить лише 50% HNO3 . В установках, що працюють під тиском 0,6-0,8 МПа, можна одержати 58-60%-ну кислоту. Піднімаючи тиск до 5 МПа, в установках прямого синтезу HNO3 з оксидів азоту і кисню одержують кислоту концентрацією 98% HNO3 .
2.2 Технологічна схема виробництва азотної кислоти
Для одержання розведеної азотної кислоти з аміаку в промисловості донедавна використовували три системи: 1) під атмосферним тиском; 2) під підвищеним тиском і 3) комбіновані, у яких окислення аміаку відбувається під атмосферним тиском, а окислення оксиду азоту й абсорбція NO2 водою - під підвищеним тиском.
Незважаючи на менші витрати платини, системи виробництва кислоти під атмосферним тиском у даний час не застосовуються через низьку продуктивність, громіздкості апаратури і відповідно значні капіталовкладення, істотні втрати аміаку і необхідність застосування дорогого і не надто ефективного лужного очищення газів, які виділяються з оксидів азоту. Сучасні установки, що працюють під підвищеним тиском (від 0,2 до 1 МПа), і комбіновані розроблені за принципом енерготехнологічних систем, у яких енергія газів (пов'язана з їх високою температурою і тиском) і теплота реакції окислення аміаку використовуються для стиску повітря і нітрозних газів, а також одержання технологічної пари. Цими ж схемами передбачено більш повне використання низкопотенційної теплоти.