Курсовая работа: Технологія виробництва азотної кислоти
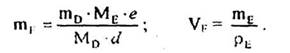
І нарешті, кількості А, В, D, Е після перебігу реакції дорівнюють:
![]()
![]()
![]()
![]()
![]()
![]()
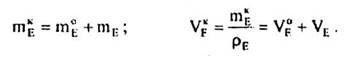
Враховуючи вихідні концентрації [молярна частка, %]
аміаку - 9 + 0,1*40 = 13%
кисню - 7 + 0,1 40 = 11%
азоту – 66 %.
Молярні маси компонентів реакції становлять
М (NH3 ) = 17 г/моль,
М (О2 ) = 32 г/моль,
М (NO) = 30 г/моль,
М (Н2 О) = 18 г/моль.
Р (NH3 ) = 17 / 22,4 = 0,76;
Р (О2 ) = 32 / 22,4 = 1,42;
Р (NO) = 30 / 22,4 = 1,34,
P (Н2 О) = 18 /22,4 = 0,8.
Тоді V (NH3 ) = 40000 / 1,34 = 29850,7 м3 ,
m0 NH 3 = ![]()
V0 (NH3 ) = ![]()
V0 = ![]()
V0 O2 = 268285.8 * 0.21 = 56340 м3
m0 O2 = 56340 * 1,42 = 80002,8 кг
V0 NO = 268285.8 * 0.66 = 177068.6 м3