Курсовая работа: Влияние испарения оксидной пленки и теплообмена излучением на высокотемпературный тепломассообмен и кинетику окисления вольфрамового проводника
При j<1 окисел не может покрыть металл сплошной пленкой. Пленка имеет пористую, ячеистую структуру и не оказывает существенного сопротивления дальнейшему окислению металла. К металлам, имеющим такую пленку, относятся Mg (j=0,81), Ва (j=0,78), Са (j=0,64), Li (j=0,58).
При j>1 пленка покрывает металл сплошным слоем. Поверхность свободно растет с внешней стороны. Компактная пленка служит эффективной преградой окислению. Такими окисными пленками обладают Al (при окислении до Al2 O3 , j=1,28), Ве (ВеО, j=1,68), Cu (CuO, j=1,72), Ni (Ni2 O3 , j=1,65), Zn (ZnO, j=1,55), W (WO2 , j=1,87).
При j>>1 защитные свойства окисла вновь утрачиваются. Это связанно с большим увеличением объема при окислении, вызывающие деформации в пленке. Так ведут себя V (V2 O5 , j=3,19), Cr (Cr2 O3 , j=3,92).
В зависимости от свойств окисной пленки изменяется кинетический закон, ![]() характеризующий окисление металла во времени. Рыхлая (j<1или j>>1), либо растворимая в металле пленка не оказывает сопротивления продвижению окислителя, скорость окисления не зависит от толщины пленки и контролируется скоростью диффузии в тонком слое воздуха у поверхности металла.
характеризующий окисление металла во времени. Рыхлая (j<1или j>>1), либо растворимая в металле пленка не оказывает сопротивления продвижению окислителя, скорость окисления не зависит от толщины пленки и контролируется скоростью диффузии в тонком слое воздуха у поверхности металла.
Экспериментально установлены различные законы окисления [2].
Распространены так называемые степенные законы окисления, при которых скорость реакции (скорость роста слоя продукта) уменьшается с ростом толщины слоя продукта обратно пропорционально толщине этого слоя в некоторой степени [3]:
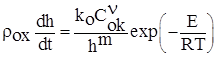 . (1.1)
. (1.1)
Здесь Сок – концентрация окислителя у поверхности частицы; n – порядок реакции по окислителю; rox – плотность оксида; k0 – предэкспоненциальный множитель; Е – энергия активации. Показатель m определяет зависимость скорости реакции от толщины слоя окиси h. В кинетической литературе название закона связывают с величиной m (m=0 – линейный, m=1 – параболический, m=2 – кубический), что соответствует интегральной форме этих законов.
Обычно m=0 и для случаев, когда продуктом реакции является пористая окисная пленка, то есть j<1. Окисление, подчиняющееся линейной закономерности, можно охарактеризовать в виде:
h=kлин t+Слин ,
где kлин – константа линейной скорости, а Слин – постоянная интегрирования.
Графически это представлено кривой 2 на рис.1.1.
h
 2
2
 1
1
![]() t
t
Рис.1.1. Параболическое (1) и линейное (2) окисление.
Скорость линейного окисления постоянна во времени и не зависит от количества уже прореагировавшего газа или металла. Если зависимость линейна, то скорость окисления лимитируется процессом или реакцией на поверхности или на фазовой границе. К ним могут, например, относится установившаяся реакция, скорость которой лимитируется подводом (адсорбцией) кислорода к поверхности, или реакция, управляемая образованием с установившейся скоростью окисла на границе раздела металл – окисел.
При m=1 (параболический закон окисления) скорость реакции определяется диффузионными процессами в твердой или жидкой окисной пленке. Появление экспоненты в законе окисления формально отражает зависимость коэффициента диффузии реагентов в окисной пленке от температуры.
Механизм окисления металлов по параболическому закону объясняют теории Вагнера и Кабрера – Мотта (для толстых и тонких пленок) [4].
Параболическое уравнение скорости записывается в интегральном виде:
h2 =kпар t+Спар ,
где kпар – константа параболической скорости, а Спар – постоянная интегрирования.
Кривая 1 (рис.1.1) описывает зависимость толщины оксидной пленки от времени для параболического закона окисления.
Параболический закон высокотемпературного окисления означает, как правило, что скорость окисления лимитируется скоростью термодиффузии. Подобный процесс может охватывать и равномерную диффузию одного или обоих реагентов через растущую плотную окалину и равномерную диффузию газа в металл.
1.2. Растворимость кислорода в вольфраме.
В связи с особыми условиями применения вольфрама в технике вопрос о продольной растворимости кислорода в кристаллической решетке вольфрама был и остается наиболее важным вопросом. Значение его особенно возросло в последнее время в связи с перспективами применения вольфрама, как самого тугоплавкого металла, а также в качестве конструкционного материала для высокотемпературной техники.
Однако до сих пор нет окончательно установленных и общепризнанных данных о взаимодействии кислорода с вольфрамом, о растворимости кислорода в вольфраме и о зависимости этой растворимости от температуры, степени чистоты исходного вольфрама и других факторов равновесия.
Поэтому в настоящем разделе мы ограничимся приведением некоторых литературных данных о растворимости кислорода в вольфраме.
При исследовании сплавов системы вольфрам—кислород было показано, что в структуре этих сплавов обнаружена только смесь чистого вольфрама и WO2 , при этом было установлено, что параметр решетки вольфрама в пределах точности измерения сохраняется постоянным при всех концентрациях кислорода. [5] Предельная растворимость кислорода в вольфраме при 1700o С равна 0,06% ат. (0,005% вес.)
Работе растворимость кислорода в вольфраме выражается ничтожной величиной 0,001% вес. (0,0011% ат.). Такое значение основывается на данных о равновесной растворимости при температуре, когда скорость диффузии равна 10-11 см2 /сек .
Анализ влияния примесей внедрения на структуру и свойства монокристалла вольфрама показал, что кислород нерастворим в совершенной кристаллической решетке вольфрама. Эти выводы делаются, к сожалению, на основании исследований монокристаллического вольфрама, содержание кислорода в котором не снижалось ниже 0,001% вес.