Курсовая работа: Влияние испарения оксидной пленки и теплообмена излучением на высокотемпературный тепломассообмен и кинетику окисления вольфрамового проводника
Положение вольфрама в группе переходных металлов в электронном строении его атомов (четыре электрона в незаполненной d -оболочке и два электрона во внешней s -оболочке) предопределяет переменную его валентность и образование окислов вольфрама с разным стехиометрическим соотношением атомов. Этим вольфрам не отличается от своих аналогов — молибдена и хрома.
Считается, что стабильными соединениями являются следующие окислы: WO, WO2 , WO3 и W2 O5 или W4 O11 . Эти окислы, за исключением W4 O11 , соответствуют валентности вольфрама. Один из низших окислов (WO) образуется на промежуточной стадии окисления. Существование других окислов, описанных в литературе (W2 O3 , W4 O3 , W5 O9 , W3 O8 и W5 O14 ), точно не установлено. Имеются данные о диссоциации стабильных окислов, однако приводимые температуры их образования и разложения нельзя считать точными. В настоящее время подтверждается существование окислов WO2 (14,82% вес. О), W4 O11 (73.33% ат. О, 19,3% вес. О) и WO3 (20,7% вес. O). Растворимость кислорода в твердом вольфраме, как было сказано выше, по-видимому, ничтожна. При рентгеновском исследовании сплавов, содержащих от 0 до 66% ат. О, в механической смеси WO2 , и металлического вольфрама период решетки последнего имел только значение, что ив чистом вольфраме.
При исследовании диаграммы состояния системы W — О в широком интервале концентрации, отмечается, что в системе W— О присутствуют четыре окисные фазы: при отношении О / W, близком к следующим величинам: 2,00 (WO2 ); 2,72 (W18 O49 ); 2,9 W20 O58 ) и 3,0 (WO3 ). Аллотропические превращения каждого из окислов не были изучены; не были также определены области гомогенности окислов. Однако поучение упругости пара указало на существование при 1280°С различных соединений с отношением W/O 1,99-2,02 (WO2 ); 2,70-2,75 (W18 O49 ); 2,90-2,94 (W20 O58 ).Была обнаружена также область гомогенности на основе окисла W18 O49 , составляющая 2,664— 2,766.
В приведенных выше исследованиях определены также энергии образования окислов WO2 , W18 O49 , W20 O58 и WO3 в температурном интервале 700— 1200° С.
При построении диаграммы состояния системы W — О в качестве исходных материалов был использован вольфрам чистотой 99,95%, а также порошок трехокиси вольфрама. Полученные металлокерамическим способом образцы были отожжены при температуре 1450°С в течение 3 ч в атмосфере водорода и аргона.
Эти исследования позволили построить диаграмму равновесия системы W — О (рис. 1.2). На этой диаграмме видно, что кислород в твердом вольфраме практически не растворяется. Первой фазой, образующейся при легировании вольфрама кислородом в условиях низких температур, является фаза состава W3 O. Это соединение образуется по реакции между вольфрамом и соединением WO2 . Соединение W3 O устойчиво только до температуры 725°C. На диаграмме также видно, что соединение W18 O49 становится нестабильным при температурах ниже 585°С. При температуре ниже 484o С оказывается нестабильным соединение W20 O58 ; оно устойчиво только в интервале 484—585o С. При температуре ниже 484°С в этой области диаграммы сосуществуют две фазы: WO2 и WO3 . Исследуемые окислы вольфрама были получены восстановлением высокотемпературной модификации трехокиси вольфрама водородом при температуре 750° С. Весовой состав окислов определяли после восстановления по потере веса лодочки с веществом. Поскольку окислы вольфрама летучи в вакууме при 750—800°С. Этим путем определяли лишь приблизительный состав. Более точно (до 0,005 г∙ am ) состав
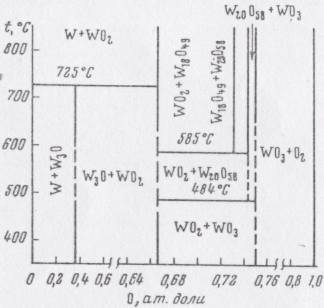
Рис. 1.2 Диаграмма состояния системы W-O
устанавливали после опыта обратным окислением до W03 при температурах 650—700°С в токе влажного кислорода.
Таким образом, из анализа литературных данных можно сделать вывод о том, что вольфрам образует с кислородом ряд окислов различного состава.
Двуокись и трехокись были известны давно, как фазы постоянного состава
с валентным соотношением атомом. Между этими двумя фазами существует
ряд менее изученных окислов неопределенного состава. До последнего времени отсутствовали надежные экспериментальные данные, подтверждающие составы этих окислов. Приготовленные образцы часто были сходны по своим физическим и химическим свойствам. Незначительное число исследований на монокристаллических образцах. Такое положение было в значительной степени изменено после внедрения рентгеноструктурного метода для исследования окислов вольфрама. Фазовый анализ с помощью рентгеноструктурного метода дал возможность различить окислы по составу и строению.
1.4 Двуокись вольфрама WO 2.
Обнаружено, что на основании этого окисла имеется область гомогенности. Ранее считалось, что структура этого окисла подобна структуре рутила (тетрагональная решетка), однако более поздними исследованиями было доказано, что в действительности структура этого окисла моноклинная.
Плотность WO2 , составляет 11,4 г/см3 . Температура плавления этого окисла 1500—1000о К, температура кипения — около 2000° К. При температуре 1050° С происходит значительная возгонка WO2 .
Бреер сообщает, что двуокись вольфрама разлагается при температуре 2125 + 50° К и давлении I am согласно уравнению
WO2 (тв.)→W(тв.)+WO3 (газ.)
Теплота образования WO2 paвна 134 0_ккал/молъ
.
1.5 Трехокись вольфрама W 03.
Трехокись вольфрама называют также вольфрамовым ангидридом. Это соединение является конечным продуктом переработки вольфрамового сырья. Упругость паров трехокиси вольфрама при температуре 1357о C достигает 1 am , но заметная возгонка начинается при значительно более низких температурах.[6-8,11]
Окисел состава WO3 существует в трех модификация, устойчивых соответственно в следующих температурных интервалах: от комнатной до 720о C, 720 — 1100о C, и выше 1100° С.
Исследования кристаллической структуры окислов вольфрама позволили сделать предположение о том, что в структуре всех окислов итого металла присутствует элементарная ячейка типа МеО6 . В угон ячейке шесть атомов кислорода окружают один атом металла, и октаэдры МeО6 соединяются между собой только вершинами. Такая ячейка очень удобна при описании всех кристаллических структур окислов вольфрама. Это соединение характеризуется структурой с низкой симметрией, состоящей из деформированных октаэдров WO6 , соединенных между собой. Из-за расхождения мнений по поводу симметрии WO3 в последнее время было проведено повторное исследование структуры WO3 и было найдено, что симметрия этого соединения является моноклинной. Приведенные данные о симметрии относятся к стабильной при комнатной температуре модификации WO3 . Эта структура при температуре
350°С переходит в орторомбическую и при температуре 735° С — в тетрагональную. Дальнейших изменений структуры окисла WO3 при повышенных температурах обнаружено не было.
При низких (—50° С) температурах происходит, другое полиморфное прекращение трехокиси вольфрама, которое приводит к более высокой симметрии, чем симметрия при комнатной температуре.
При исследовании рентгенографическим методом порошков WO3 не было найдено каких-либо отклонений от моноклинной формы, в то время как при оптическом изучении монокристаллов была определена триклинная симметрия. Но все же симметрия является моноклинной.
1.6 Окисление вольфрама.
Детально исследовано поведение вольфрама и окислов на его поверхности в окислительных атмосферах в зависимости от температуры окисления, давления кислорода в интервале 500—1300о С и длительности выдержки при этих температурах. В этом же исследовании были изучены физическая природа и кристаллическая структура окисной пленки на поверхности вольфрама, а также механизм реакции взаимодействия вольфрама с кислородом.
Скорость окисления вольфрама в интервале между 400—500°C подчиняется параболическому закону. Энергия активации процесса окисления в этом интервале температур оказалась равной 45,65 ккал/моль. Окись вольфрама в виде толстых пленок начинала улетучиваться при температуре 800°С; теплота активации в интервале температур 390—487°C в значительной степени определялась исходным состоянием поверхности. Теплота активации, вычисленная на основании экспериментально полученной константы параболического закона скорости окисления, оказалась равной 46,5 ккал/моль при исследовании образцов электрополированной поверхностью и 41,0 ккал/моль при изучении механически полированных образцов.
Исследовано окисление вольфрама в интервале температур 700—1000°С и найдено, что и в этом интервале действует параболический закон скорости окисления. Также замечены некоторые отклонения при 850— 900°С, которые объяснялись фазовыми превращениями в окисных пленках. Эти фазовые прекращении окисных пленок па поверхности могут быть связаны с реакцией 2W3 O→5W+WO2 , хотя прямых экспериментальных данных, подтверждающих это, нет. Изучалась скорость окисления вольфрама при 500 и 700°С, и длительной выдержке при каждой температуре и установлен линейный закон изменения скорости окисления.
В исследовании скорости окисления вольфрама в температурном интервале 700—1000°С обнаружено, что скорость окисления вначале изменяется по параболическому закону, а затем, когда толщина окисной пленки увеличивается, по линейному. Установлен слоистый характер пленок на поверхности вольфрама. Наружный слой представлял собой пористую трехокись вольфрама желтого цвета, а внутренний слой — тонкую плотно прилегающую пленку окислов неопределенного состава. Скорость образования внутреннего слоя подчинялась параболическому закону, внешнего же — линейному.
Исследовалось влияние давления на скорость окисления вольфрама при температурах 600—850°С. Скорость окисления линейно возрастала с повышением давления.
Скорость окисления определяется диффузией кислорода. С повышением температуры выше 1150°С линейный закон скорости окисления меняется на параболический, что предположительно объяснялось оплавлением окислов.
1.7 Влияние температуры на окисление вольфрама.
Шлифованные образцы были окислены в интервале температур 500—1150°С при давлении очищенного кислорода 0,1 ат. По мере увеличения толщины окисной пленки скорость реакции снижается . Расчеты показали, что при 600°С за 6 ч выдержки па вольфраме образуется окисная пленка толщиной 100000 А.