Лабораторная работа: Контрольный синтез Mg(NO3)2 – MgO – MgCl2
Цель работы: Изучить цепочку синтеза Mg(NO3 )2 - MgO - MgCl2 , и осуществить ее на практике. Рассмотреть физико-химические характеристики веществ, участвующих в химических реакциях при синтезе MgCl2 из Mg(NO3 )2 , их химические свойства, и методы качественного и количественного анализа соединений магния.
1). Химический синтез оксида магния ( MgO ) из нитрата магния Mg ( NO 3 )2
Mg ( NO 3 )2 → MgO
Физико – химическая характеристика Mg ( NO 3 )2 :
1. Встречается в природе в небольших количествах в виде нитромагнезита (гидрат), или магнезиевой селитры.
2. Нитрат магния при обычных условиях кристаллогидрат состава Mg(NO3 )2 · nH2 O, где n- 2, 6, 9, n зависит от способа выделения нитрата магния и температурного режима.
3. Соединение Mg(NO3 )2 · 2H2 O представляет собой бесцветные кристаллы с плотностью 2,025 г/см3 , плавятся при 129,5 °С, растворимы в воде, спирте и концентрированной азотной кислоте.
4. Mg(NO3 )2 · 6H2 O – бесцветные призматические кристаллы моноклинной формы с плотностью 1,464 г/см3 ; они плавятся при температуре 95°С, кипят при 143°С, также растворимы в воде, спирте и концентрированной азотной кислоте.
5. Mg(NO3 )2 · 9H2 O бесцветные кристаллы с плотностью 1,356 г/см3 плавятся при 74°С, плотность 1,302 г/см3
6. Растворимость безводной соли в воде (на 100 г) при 20°С 73,3 г (42,3 %), при повышении температуры растворимость повышается и при 80°С она составляет 110,1 г (52,4 %).
7. Выделен также неустойчивый кристаллогидрат состава Mg(NO3 )2 · 4H2 O плавящийся при температуре 52 °С.
8. Легко теряет кристаллизационную воду по следующей схеме:
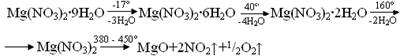
При температуре выше 380° разлагается.
9. При неполном разложении кристаллогидратов получаются продукты различного состава 2Mg(NO3 )2 · MgO, Mg(NO3 )2 · Mg(OН)2 , Mg(NO3 )2 ·3Mg(OН)2 ·8H2 O, Mg(NO3 )2 ·2Mg(OН)2 ·4H2 O и т. д.
10. Растворяется в безводном жидком аммиаке и абсолютизированном спирте, образуя аддукты различного состава:
Mg(NO3 )2 + nNH3 = Mg(NO3 )2 · nNH3 (n=1, 2, 4, 6)
Mg(NO3 )2 + 6CH3 OH = Mg(NO3 )2 · 6CH3 OH
Mg(NO3 )2 + 6C2 H5 OH = Mg(NO3 )2 · 6C2 H5 OH.
11. Водный раствор Mg(NO3 )2 имеет кислую среду раствора вследствие гидролиза по катиону: Mg(NO3 )2 + H2 O ↔MgOHNO3 + 2HNO3
Mg2+ + H2 O ↔ MgOH+ + H+ (гидролиз по первой ступени)
MgOHNO3 + H2 O ↔ Mg(OH)2 ↓+ HNO3
MgOH+ + H2 O ↔ Mg(OH)2 ↓+ H+ (гидролиз по второй ступени)
12. При взаимодействии с растворами щелочей выпадает белый осадок гидроксида магния Mg(OH)2.
Mg(NO3 )2 +2NaOH = Mg(OH)2 ↓+ 2Na NO3 .
13. Не растворяется в растворах плавиковой, фосфорной, угольной, кремниевой кислот, химически взаимодействует с ними с образованием нерастворимых в воде солей:
Mg(NO3 )2 + 2HF = MgF2 ↓+ 2HNO3 ;
3Mg(NO3 )2 + 2H3 PO4 = Mg3 (PO4 )2 ↓+ 6HNO3 ;
Mg(NO3 )2 + CO2 + H2 O = MgCO3 ↓+2HNO3 ;
Mg(NO3 )2 + H2 SiO3 = MgSiO3 ↓+2HNO3
Сильно (все выпавшие осадки белого цвета). разбавленная
Физико – химическая характеристика MgO
1. Белая или жженая магнезия -MgO белый рыхлый порошок (кристаллы октаэдрической формы) плавится при температуре 2800°С, кипит при t = 3600°С;
--> ЧИТАТЬ ПОЛНОСТЬЮ <--