Реферат: Алкалоиды - производные индола
1.3. Накопление в растениях.
В начале вегетации до появления листьев алкалоиды из корней, семян и коры переходят в ростки. В подземных органах число и сумма алкалоидов уменьшаются, в коре их число остается прежним, но сумма также уменьшается. Качественные и количественные изменения алкалоидного состава продолжаются в течение всего периода вегетации. К концу вегетации в растениях накапливается максимальное количество смеси оснований. Далее их количество начинает уменьшаться, алкалоиды накапливаются в зимующей части растения для перехода в следующее поколение – в семена, в подземную часть, у древесных пород – в кору. В естественно отмерших частях растения алкалоидов практически не остается. Вместе с тем не исключено, что алкалоиды в этих органах могут разрушаться самостоятельно, на фоне накопления их в зимующих органах (7).
Подвижность алкалоидов в растениях вызывается не только онтогенетическими факторами, но также географическим положением и влиянием факторов окружающей среды (5).
Большинство растений–источников индольных алкалоидов – тропические растения, деревья или кустарники, ареал которых расположен главным образом в юго-восточной части Азии, Северной Австралии и Океании. Эти растения содержат достаточно сложные по своей структуре полициклические алкалоиды. При продвижении на север общее количество алкалоидов снижается, а их структура несколько упрощается и представлена в основном b-карболиновыми алкалоидами. Это связано со снижением скорости обмена и интенсивности включения терпеноидных структур в молекулу алкалоида (3),(8).
1.4. Общие пути биосинтеза.
Все индольные алкалоиды в биогенетически являются производными аминокислоты триптофана (8). Сама аминокислота не является незаменимой для растений и синтезируется из хоризмовой кислоты – метаболита шикиматного пути биосинтеза ароматических аминокислот (5).
Дальнейшие превращения триптофана могут идти по нескольким путям. В большинстве случаев первой реакцией является его декарбоксилирование с образованием биогенного амина – триптамина (1):

Далее возможно несколько вариантов превращений: триптамин может алкилироваться по аминогруппе и гидроксилироваться в бензольное кольцо, в результате чего образуется группа простейших индольных алкалоидов – индолалкиламины (8):

Группировки R1 и R2 почти всегда представлены метильными или этильными радикалами, R3 , R4 и R5 – гидрокси- или метоксигруппами.
Триптамин может циклизоваться с образованием структуры физостигмина (8):

Образование иной циклической структуры из триптамина возможно после его предварительного ацилирования с помощью активированного ацетила – ацетил KoA.

После циклизации образуется гармалин – родоначальник обширной группы b-карболиновых алкалоидов.

Далее он может окисляться в гарман (I) или восстанавливаться в тетрагидрогарман (II), а также образовывать более сложные структуры при соединении с другими соединениями, например бревиколлин (III), образующийся в осоке парвской – Carex brevicollis D.C., структура которого включает кроме гармана еще и пирролидиновое ядро (6),(9).
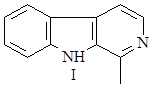


Наиболее интересен биосинтез терпеноидных алкалоидов. Он заключается в конденсации триптамина с циклическим иридоидным альдегидом – секологанином:
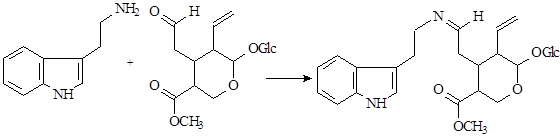
На первой стадии образуется шиффово основание, которое по механизму реакции Манниха – Шпенглера циклизуется с образованием стриктозидина (винкозида) - родоначальника всех монотерпеноидных индольных алкалоидов (10):
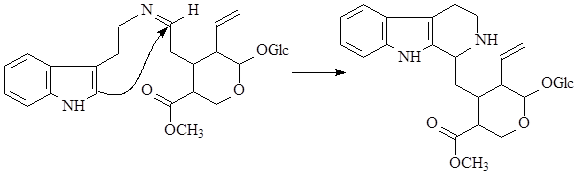
Особое место в биосинтезе индольных алкалоидов занимает биосинтез эрголиновых алкалоидов. В первую очередь он отличается от всех остальных путей тем, что в метаболизм включается непосредственно аминокислота триптофан, а не триптамин. Вначале, в результате взаимодействия триптофана и структурной единицы терпенов - диметилаллилпирофософата образуется 4-диметилаллилтриптофан, который в дальнейшем претерпевает последовательное замыкание двух связей и декарбоксилирование. После окисления боковой метильной группы образуется лизергиновая кислота, которая, соединяясь с рядом аминокислот, образует уникальную группу пептидных алкалоидов, встречающихся только в склероциях спорыньи – Claviceps purpurea (Fries) Tulasne (11):
Относительно роли индольных алкалоидов в растении есть предположение, что их образование оберегает растения от избыточного накопления гетероауксина – фитогормона, стимулятора роста растений, т.е. алкалоиды выполняют регуляторную функцию (3).
Регуляция биосинтеза и метаболизма алкалоидов происходит либо по аминокислотному пути, либо через белковый (энзиматический) путь.
О взаимосвязи между биосинтезом алкалоидов и пулом свободных аминокислот свидетельствуют данные об увеличении содержания алкалоидов в 2 раза при добавлении в среду ткани катарантуса розового – Catharanthus roseus (L.) G.Don больших количеств триптофана. В опытах с некоторыми штаммами введение экзогенного триптофана позволило достичь трехкратного увеличения содержания серпентина и аймалицина.
Увеличение пула свободных аминокислот наблюдается при ингибировании синтеза белка различными веществами.
Что касается активации биосинтеза, то получен целый ряд данных, свидетельствующих о том, что участие аминокислот в образовании алкалоидов не ограничивается только ролью предшественников, субстрата для биосинтеза. Напротив имеются указания на то, что аминокислоты являются индукторами ферментов биосинтеза алкалоидов и, следовательно, выполняют определенную регуляторную функцию в их биосинтезе. Однако при высоких концентрациях триптофана наблюдается снижение образования алкалоидов, без нарушения роста и развития растений, что исключает токсическое влияние триптофана на растение и позволяет сделать вывод о репрессии ферментов, ответственных за синтез этих алкалоидов.
Регуляция образования алкалоидов осуществляется также путем аллостерического ингибирования ключевых ферментов их биосинтеза конечными продуктами реакций. Так, в опытах с культурой ткани барвинка розового было показано снижение активности в среднем на 50% цитохром Р-450-зависимой монооксигеназы такими алкалоидами как катарантин, винбластин и виндолин, т.е. конечными продуктами биосинтеза. Дополнительное изучение кинетики выявило, что этот процесс является неконкурентным и линейным, т.е. аллостерическим (8).
1.5. Качественный анализ.
Все индольные алкалоиды дают осадочные реакции с общеалкалоидными реактивами, такими как реактив Майера, реактив Марме, 1% растворы фосфорномолибденовой, фосфорновольфрамовой, кремневольфрамовой кислот и др. (2).
Еще более быстрый и простой метод качественного анализа основан на способности ряда алкалоидов флуоресцировать в ультрафиолетовом свете. Это свойство больше характерно для производных гармана. Для того чтобы обнаружить алкалоиды, достаточно нанести на фильтровальную бумагу каплю водной вытяжки или сока растения. Пятно светится при ультрафиолетовом облучении. Этот способ можно использовать как экспресс-метод, так как в этом случае выявить алкалоиды можно в течение нескольких секунд, что важно при массовых анализах в период заготовительных работ, когда необходимо отличать производящее растение от примесей (9).
Для идентификации индольных алкалоидов часто используют 1% раствор пикриновой кислоты, дающей с алкалоидами стехиометрические кристаллические осадки, которые отфильтровывают, сушат и определяют температуру плавления (12).
В качестве достаточно высокоспецифичной реакции на различные группы индольных алкалоидов используют т.н. тест Эрлиха – реакцию виннокислой соли алкалоида с раствором п-диметиламинобензальдегидом в 65% серной кислоте. После воздействия света ртутной лампы или в присутствии следов хлорного железа развивается интенсивное окрашивание, варьирующее в зависимости от типа алкалоида от пурпурного до ярко-синего. Причиной окрашивания является образование хиноидного соединения типа розиндола, существующего в двух таутомерных формах:
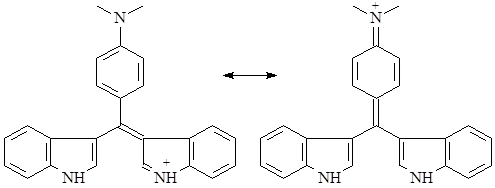
Реакция протекает быстро для алкалоидов со свободным С3 -положением и не имеющих электронодонорных групп в ядре, медленнее – для С3 -замещенных алкалоидов, но не содержащих свободных аминов в этом заместителе и электронодонорных групп в ядре. Реакция не идет в случае с алкалоидами, имеющими аминосодержащий заместитель в 3 положении и электронодонорные группы в ядре. В качестве заменителя п-диметиламинобензальдегида можно использовать ванилин в концентрированной серной кислоте, при этом развивается красное окрашивание. По реакции Гопкинса-Коуля с глиоксиловой кислотой в концентрированной серной кислоте кислотой развивается сине-фиолетовое окрашивание (13).
Однако наиболее тонким и селективным методом анализа является бумажная или тонкослойная хроматография. Наиболее часто применяется система бутанол-уксусная кислота-вода в различных соотношениях. Хроматограммы проявляют реактивом Драгендорфа, дающего с алкалоидами оранжевые пятна, и сравнивают коэффициенты подвижности (Rf ) опытных образцов и веществ-свидетелей (9).