Реферат: Энергия активации
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Химическая кинетика - это наука о скоростях и механизмах химических превращений, о явлениях, сопровождающих эти превращения, и о факторах, влияющих на них.
Механизм реакции - это последовательность стадий, предлагаемая на основании экспериментально установленных данных о скорости реакции и на экспериментально обнаруженных интер-медиатах реакции (промежуточных продуктах).
Кинетика по способу описания химических реакции делится на два раздела. В формальной или феноменологической кинетике сформулированы закономерности, позволяющие описывать химическую реакцию макроскопически на основе экспериментальных данных. Молекулярная кинетика изучает превращение на основе молекулярных данных о свойствах частиц.
Теоретическую основу химической кинетики составляют теории столкновений и переходного состояния.
Теория столкновений позволяет объяснить влияние концентрации и температуры на скорости реакций.
Теория переходного состояния рассматривает изменение в геометрическом расположении атомов реагирующих молекул как единой системы.
Переходным состоянием или активированным комплексом называется критическая конфигурация, которой соответствует максимум потенциальной энергии вдоль координаты реакции.
Реагирующие молекулы, которые достигают этой критической конфигурации, образуют молекулы продуктов.
Кинетические исследования позволяют определить порядок и константу скорости реакции, число и характер промежуточных продуктов, энергию активации реакции, выяснить влияние природы растворителя, установить характер и число связей, разрываемых в ходе реакции и т.п.
Рассмотрим основные понятия химической кинетики.
1.1 Скорость, константа скорости, порядок и молекулярность химической реакции
С течением времени в процессе химической реакции происходит изменение количеств исходных веществ и продуктов реакции. Эти изменения могут быть различными из-за разных стехиометрических коэффициентов у веществ, принимающих участие в химической реакции. Поэтому, при рассмотрении скорости реакции введены два понятия: скорость реакции по данному веществуи скорость реакции в целом (просто скорость реакции).
Скоростью реакции называется изменение количества i-того вещества (в молях) в единицу времени в единице реакционного пространства R:
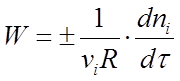 (1)
(1)
где ni - число молей i-го вещества, израсходованное или полученное в ходе реакции.
Это определение скорости является наиболее общим. Оно справедливо для любых условий, в том числе и для неизотермических.
Если реакция гетерогенная и протекает на границе раздела фаз, то реакционным пространством является поверхность (R = S), и изменение количества вещества относится к единице поверхности. Если реакция гомогенная и протекает в объеме, то реакционным пространством является объем (R = V). Изменение количества вещества рассматривается в единице объема. При условии V = const выражение (1) принимает вид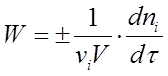 (2)
(2)
Если учесть, что ni /V = Сi , тогда вместо (2) получим
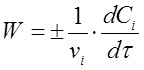 (3)
(3)
где vi - стехиометрический коэффициент перед i-тым веществом в уравнении химической реакции;
Сi - концентрация i-того вещества, моль/л;
τ - время реакции, с.
В данном случае скорость химической реакции численно равна изменению концентрации одного из реагирующих веществ в единицу времени.
Из уравнения (3) следует, что скорость реакции всегда положительна. Производная d Сi /d τ характеризует скорость реакции по данному веществу. Она имеет отрицательное значение для исходных веществ веществ, так как их концентрация в ходе реакции уменьшается, и по ложительное для продуктов реакции. Их количествов течение времени возрастает.
Основным законом химической кинетики является закон действующих масс , выражающий зависимость скорости химической реакции от концентрации реагирующих (исходных) веществ, который записывают в виде
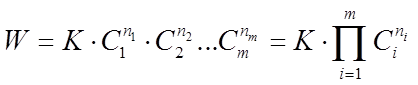 (3)
(3)
где К - коэффициент пропорциональности или константа скорости химической реакции, численно равная скорости данной реакции при равенстве единице концентраций всех исходных веществ;
n1 , n2 , .... nm - показатели степени - порядки реакции по индивидуальным веществам;
--> ЧИТАТЬ ПОЛНОСТЬЮ <--